
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример решения 5.1
|
|
|
|
Моляльность раствора.
Нормальность.
Молярность.
Процентную концентрацию (%, масс.).
Для примера рассмотрим водный раствор соли Pb(NO3)2 объемом V = 0,5 л, плотность которого ρ = 1016 кг/м3 = 1016 г/л. Масса растворенного вещества m = 10 г. Необходимо выразить концентрацию раствора в разных вариантах.
Концентрация растворов обозначается: c, или [ ], например с (KCl), или [KCl]. Чаще всего используется второй вариант. Для концентрированных растворов вместо концентрации используется активность раствора (а), где а = γ · с. Величина γ – коэффициент активности – представляет собой поправочный коэффициент, учитывающий взаимодействие частиц реального раствора, приводящее к изменению концентрации. Для разбавленных растворов γ → 1, и вместо активности используется значение концентрации. При выполнении требуемых заданий коэффициент активности не учитывается.
5.1.1. Определим процентную концентрацию раствора. Процентная концентрация (% масс.) показывает, сколько граммов вещества содержится в 100 г раствора. Сначала вычислим массу раствора, содержащегося в 0,5 л:
m р-ра = V · ρ = 0,5 л × 1016 г/л = 508 г.
Если в 508 г раствора содержится 10 г Pb(NO3)2,
то в 100 г раствора содержится х -"- -"- -"-
х =  = 1,97,
= 1,97,
т. е. раствор имеет концентрацию равную 1,97 % масс.
5.1.2. Определяем молярную концентрацию раствора. Молярная концентрация (молярность) раствора сМ (моль/л) показывает, какое число молей растворенного вещества содержится в 1 л раствора.
Рассчитаем молярную массу растворенного вещества – Pb(NO3)2:
М (Pb(NO3)2) = 207,2 + 2(14+3·16) = 331,2 г.
Определим число молей Pb(NO3)2, которое содержится в 0,5 л раствора:
1 моль Pb(NO3)2 содержит 331,2 г Pb(NO3)2
х молей Pb(NO3)2 содержит 10 г Pb(NO3)2
х = 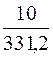 = 0,0302 моля.
= 0,0302 моля.
Затем выясним, сколько молей соли находится в 1 л раствора, если известно, что в 0,5 л содержится 0,0302 моля Pb(NO3)2.
0,5 л раствора содержит 0,0302 моля
1 л раствора содержит х моль
х = 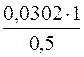 = 0,0604 моля.
= 0,0604 моля.
Таким образом, молярность раствора с М равна 0,0604 моль/л.
5.1.3. Определяем нормальность раствора (молярную концентрацию эквивалента).
Молярная концентрация эквивалента, с экв. или нормальность, н, (моль-экв./л) показывает, какое число молярных масс эквивалента растворенного вещества содержится в 1 л раствора.
Сначала рассчитаем молярную массу эквивалента Mэкв. Pb(NO3)2. Она определяется как отношение молярной массы соли к произведению числа ионов металла на его валентность.
Mэкв. (Pb(NO3)2) = 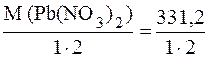 = 165,6 г.
= 165,6 г.
Затем находим молярную концентрацию эквивалента (нормальность) раствора:
так как в 0,5 л раствора содержится 10 г Pb(NO3)2,
то в 1 л раствора содержится х г Pb(NO3)2
х = 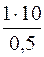 = 20 г.
= 20 г.
В этой массе число молярных эквивалентов составляет:
с экв. = 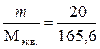 = 0,121 моль-экв.
= 0,121 моль-экв.
Таким образом, молярная концентрация эквивалента (нормальность) раствора Pb(NO3)2 с экв составляет 0,121 моль-экв.
5.1.4. Определяем моляльность раствора.
Моляльность раствора сm (моль/кг) показывает, какое число молей растворенного вещества приходится на 1 кг растворителя (воды).
Сначала рассчитаем массу воды в 0,5 л раствора:
m (Н2О) = m (раствора) - m (Pb(NO3)2) = 508 г - 10 г = 498 г.
Число молей растворенного вещества в 0,5 л, рассчитанное ранее в 5.1.2, составляет 0,0302.
Далее, если в 498 г воды содержится 0,0302 моля Pb(NO3)2,
то в 1000 г воды содержится х моль Pb(NO3)2.
х = 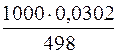 = 0,061 моль/г.
= 0,061 моль/г.
Таким образом моляльность раствора сm составляет 0,061 моль/г.
Задание 5.2. Рассчитайте рН раствора кислоты или щелочи, если известна ее молярная концентрация с М (моль/л) (табл. V.2).
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 2014; Нарушение авторских прав?; Мы поможем в написании вашей работы!