
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример решения 3.2
|
|
|
|
По закону Гесса тепловой эффект реакции зависит от природы и состояния конечных продуктов и исходных веществ, но не зависит от пути протекания реакции, т.е. от числа и характера промежуточных стадий, т.е., при расчете D H0 химической реакции (Δ H 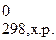 ):
):
Δ H 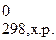 = ∑Δ Н 0f, продуктов реакции − ∑Δ Н 0f, исходных веществ
= ∑Δ Н 0f, продуктов реакции − ∑Δ Н 0f, исходных веществ
При этом следует учитывать число молей веществ в уравнении химической реакции.
Так для реакции:
а1А1 + а2А2 +...= b1В1 + b2В2 +...,
где a i – число молей для исходных веществ; A i – исходные вещества; b i – число молей для продуктов; B i – конечные продукты,
Δ Н 0298, х.р. = (b1Δ H 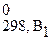 + b2Δ H
+ b2Δ H 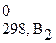 +...) – (a1Δ H
+...) – (a1Δ H 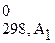 + a2Δ H
+ a2Δ H 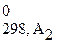 +...).
+...).
Значения термодинамических параметров, приведенных в Приложении 2, даны для одного моля вещества. Стандартная энтальпия образования вещества обозначается Δ H 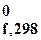 .
.
В качестве примера рассчитаем Δ H 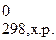 для следующей химической реакции:
для следующей химической реакции:
2СО (г) + 2Н2 (г) = СН4 (г) + СО2 (г).
Δ Н 0298, х.р.= (Δ H 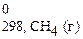 + Δ H
+ Δ H 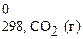 ) − (2 Δ H
) − (2 Δ H 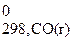 + 2Δ H
+ 2Δ H 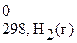 ) =
) =
= (-74,85+ (-396,3)) − (2×(-110,5) + 2×0) = -250,15 кДж.
Так как энтальпия системы уменьшается (Δ Н < 0), то тепло выделяется. Следовательно, данная реакция является экзотермической.
Аналогично рассчитаем Δ S 0298 химической реакции.
Энтропия вещества определяет меру беспорядка в системе и представлена значением S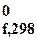 . Единица измерения энтропии: Дж/моль·К.
. Единица измерения энтропии: Дж/моль·К.
Δ S 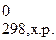 =(S
=(S 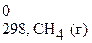 + S
+ S 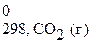 )−(2 S
)−(2 S 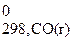 +2 S
+2 S 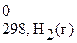 ) = =(186,19+213,6)−(2×197,4 + 2×130,6) = -794,59 Дж/К = -0,795 кДж/К.
) = =(186,19+213,6)−(2×197,4 + 2×130,6) = -794,59 Дж/К = -0,795 кДж/К.
Так как энтропия системы уменьшается (ΔS < 0), следовательно, система стала обладать большей степенью упорядоченности.
Переходим к расчету Δ G 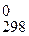 химической реакции. Значение Δ G
химической реакции. Значение Δ G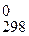 химической реакции рассматривается как изменение свободной энергии системы (энергии Гиббса) – энергии, используемой для совершения полезной работы.
химической реакции рассматривается как изменение свободной энергии системы (энергии Гиббса) – энергии, используемой для совершения полезной работы.
Δ G 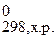 = Δ H
= Δ H 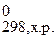 − Т×Δ S
− Т×Δ S 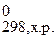
При расчете Δ G 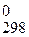 химической реакции, согласно второму закону термодинамики, от полной энергии, связанной с Δ Н реакции отнимается энергия "беспорядка", т.е. – произведение Т×Δ S. В результате получается "энергия порядка", а порядок характеризует работу, которую может совершить система.
химической реакции, согласно второму закону термодинамики, от полной энергии, связанной с Δ Н реакции отнимается энергия "беспорядка", т.е. – произведение Т×Δ S. В результате получается "энергия порядка", а порядок характеризует работу, которую может совершить система.
Если свободная энергия системы уменьшается (Δ G х.р.<0), значит химическая реакция термодинамически вероятна.
Реакция не может протекать самопроизвольно, если Δ G х.р.>0, т.е., если свободная энергия возрастает, то на совершение работы требуются затраты энергии извне.
При Δ G х.р.=0 система находится в состоянии термодинамического равновесия.
Согласно вышеприведенной формуле,
Δ G 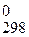 = (-250,15) − 298×(-0,795) = +13,24 кДж,
= (-250,15) − 298×(-0,795) = +13,24 кДж,
т.е. реакция при 298 К и Р = 101,3 кПа термодинамически не возможна.
Рассчитаем температуру начала реакции, т.е. Травн.. Для этого исходим из условия термодинамического равновесия, при которомΔ G х.р.=0:
Δ G 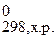 = Δ H
= Δ H 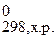 − Т×Δ S
− Т×Δ S 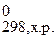 = 0.
= 0.
Тогда Т = 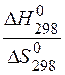 =
= 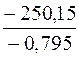 = 314,65 К,
= 314,65 К,
ниже этой температуры реакция будет термодинамически возможной, так как Δ G 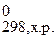 примет значение меньше нуля.
примет значение меньше нуля.
Таблица III.1
| Вариант | Элемент | Масса элемента, г | Формула оксида | Выделенное тепло, кДж |
| Fe | FeO | -2648 | ||
| Si | 2,8 | SiO2 | -90,8 | |
| Li | Li2O | 1190,8 | ||
| Ca | CaO | 2542,0 | ||
| Fe | 11,2 | Fe2O3 | -82,2 | |
| S | SO2 | -1485,3 | ||
| Na | Na2O | -416,3 | ||
| K | K2O | -726,4 | ||
| Cr | CrO3 | -292,8 | ||
| Zn | ZnO | -70,1 | ||
| Ca | CaO | -79,4 | ||
| Mg | MgO | -300,5 | ||
| B | 21,6 | B2O3 | -1254,0 | |
| P | P2O5 | -6192,3 | ||
| Be | BeO | -1197,0 | ||
| Ag | Ag2O | -7,7 | ||
| Cs | 26,6 | Cs2O | -31,7 | |
| Cu | CuO | -324 | ||
| Rb | 17,1 | Rb2O | -33,0 | |
| Sr | SrO | -2952,0 | ||
| Ti | TiO | -1579,0 | ||
| Ge | 145,2 | GeO | -510,0 | |
| Al | 27,0 | Al2O3 | -837,5 | |
| C | 60,0 | CO2 | -1967,5 | |
| As | 75,0 | As2O5 | -462,5 | |
| Ba | 68,5 | BaO | -279,0 | |
| C | 36,0 | CO | -331,5 | |
| Cu | 32,0 | Cu2O | -43,3 | |
| N | 70,0 | N2O | +205,2 | |
| H | 4,0 | H2O | -483,6 |
Таблица III.2
| Номер варианта | Уравнение реакции |
| CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) | |
| CO (г) + H2O (г) = CO2 (г) + H2 (г) | |
| 2H2S (г) + 3O2 = 2H2O (ж) + 2SO2 (г) | |
| 2CH3OH (ж) + 3O2 (г) = 4H2O (ж) + 2CO2 (г) | |
| 4HCl (г) + O2 (г) = 2Cl2 (г) + 2H2O (г) | |
| CaCO3 (к) + HCl (ж) = CaCl2 (к) + CO (г) | |
| 3Fе2О3 (к) + Н2 (г) = 2Fе3O4 (к) + Н2О (г) | |
| Fе2О3 (к) + 3Н2 (г) = 2Fе (к) + 3Н2О (г) | |
| Fе3О4 (к) + 4Н2 (г) = 3Fе (к) + 4Н2О (г) | |
| Fе3О4 (к) + Н2 (г) = 3FеО (к) + Н2О (г) | |
| СО (г) + 2Н2 (г) = СН3ОН (ж) | |
| СО(г) + 3Н2 (г) = СН4 (г) + Н2О (г) | |
| MgО (к) + H2 (г) = MgCO3 (к) + H2O (ж) | |
| C (граф) + 2 N2O (г) = CO2 + 2 N2 (г) | |
| 4NH3 (г) + 3O2 (г) = 2N2 (г) +6H2O (ж) | |
| SO2 (г) + CO2 (г) = SO3 (г) + CO (г) | |
| 4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г) | |
| 2Cl2 (г) + O2 (г) = 2Cl2O (г) | |
| 2ZnS (к) + 3O2 (г) = 2ZnO (к) + 2SO2 (г) | |
| CaO (к) + 3C (граф) = CaC2 (к) + CO (г) | |
| H2S (г) + Cl2 (г) = 2HCl (г) + S (к) | |
| H2S (г) + I2 (г) = 2HI (г) + S (к) | |
| Al2O3 (к) + 3SO3 (г) = Al2(SO4)3 (к) | |
| 2H2S (г) + O2 (г) = 2H2O (г) + 2S (к) | |
| 4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г) | |
| 2P (т) + Н2 (г) + 3О2 (г) = 2 НРО3 (ж) | |
| С2Н5ОН (ж) + 3О2 (г) = 2СО2 (г) + 3Н2О (г) | |
| 2NH4NO3 (к) = 4Н2О (г) + О2 (г) + 2N2 (г) | |
| 2PbS (к) + 3О2 (г) = 2PbO (к) + 2SO2 (г) | |
| SO2 (г) + 2H2S (г) = 3S (к) + 2Н2О (г) |
Тема IV. ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 697; Нарушение авторских прав?; Мы поможем в написании вашей работы!