
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример решения 2.1
|
|
|
|
Определить полярность связей и полярность молекулы в целом.
Какова пространственная структура молекулы?
Каков тип гибридизации центрального атома в молекуле и валентный угол между связями?
2.1.3. Сколько σ- и π- связей содержит молекула?
Для ответа на вопросы задания рассмотрим молекулу CdI2.
2.1.1. Сначала определяем тип гибридизации центрального атома. Для этого выписываем валентные электроны центрального атома 48Cd.
 |
 |
 |
Затем 5 s электроны переводим в возбужденное состояние.
 | 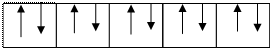 |
Таким образом, Cd предоставляет на связь два неспаренных электрона.
Далее выписываем валентные электроны йода.
 |  |
У йода имеется один неспаренный электрон. Следовательно, согласно Льюису молекула CdI2 выглядит следующим образом:
 .
.
Далее изображаем молекулу CdI2 с использованием представлений о гибридизации орбиталей центрального атома.
Отмечаем, что у Cd имеются две внешние орбитали: s и р. Представим s - и р -орбитали на рис. 2.1.
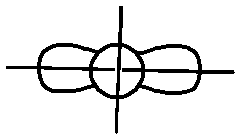
Рис. 2.1
Таким образом, с одной р -орбиталью йода кадмий связывается с помощью s -орбитали, а с другой – с помощью р -орбитали. Так как связи отличаются по форме и энергии, то такая молекула не будет устойчивой. Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис. 2.2.

Рис. 2.2
Гибридизация – процесс, в результате которого происходит перестройка валентных орбиталей центрального атома и образование смешанных гибридных орбиталей, одинаковых по форме и энергии.
Таким образом, при гибридизации s - и p -орбиталей образуются две равноценные sp -гибридные орбитали (s + p = 2 sp). По аналогии: s + p + p = 3 sp 2, образуются три равноценные sp 2-гибридные орбитали; s + p + p + p = 4 sp 3, образуются четыре равноценные sp 3-гибридные орбитали.
Гибридные орбитали центрального атома располагаются под определенным углом (валентный угол), чтобы образовалась устойчивая молекула: при гибридизации типа sp валентный угол составляет 180 о; sp 2 – 120 о; sp 3 – 109 о. Расположение гибридных орбиталей под определенным углом показано в табл. 2.1.
Таблица 2.1
| Тип гибридизации: | sp | sp 2 | sp 3 |
| Расположение гибридных орбиталей в простран-стве |

| 
| 
|
| Теоретический валентный угол | 180 о | 120 о | 109 о |
В соответствии с данными табл. 2.1 в молекуле CdI2 реализуется sp -гибридизация, и валентный угол составляет 180 о.
Чтобы изобразить молекулу в целом, остается показать перекрывание полученных гибридных орбиталей центрального атома с валентными орбиталями боковых атомов. В случае рассматриваемой молекулы CdI2 боковым атомом является 53I. Так как это р -элемент, то его валентные наружные электроны имеют орбиталь в виде гантели. В случае, если это будет s -элемент, то форма орбитали в виде шара.
"Подводя" валентные орбитали йода к гибридным орбиталям кадмия, получаем схему молекулы CdI2 (рис. 2.3).
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 991; Нарушение авторских прав?; Мы поможем в написании вашей работы!