
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Двухцентровые молекулярные орбитали
|
|
|
|
Метод молекулярных орбиталей
При использовании метода молекулярных орбиталей считается, в отличие от метода валентных связей, что каждый электрон находится в поле всех ядер. При этом связь не обязательно образована парой электронов. Например, ион Н2+ состоит из двух протонов и одного электрона. Между двумя протонами действуют силы отталкивания (рис. 30), между каждым из протонов и электроном - силы притяжения. Химическая частица образуется лишь в том случае, если взаимное отталкивание протонов компенсируется их притяжением к электрону. Это возможно, если электрон расположен между ядрами - в области связывания (рис. 31). В противном случае силы отталкивания не компенсируются силами притяжения - говорят, что электрон находится в области антисвязывания, или разрыхления.
В методе молекулярных орбиталей для описания распределения электронной плотности в молекуле используется представление о молекулярной орбитали (подобно атомной орбитали для атома). Молекулярные орбитали - волновые функции электрона в молекуле или другой многоатомной химической частице. Каждая молекулярная орбиталь (МО), как и атомная орбиталь (АО), может быть занята одним или двумя электронами. Состояние электрона в области связывания описывает связывающая молекулярная орбиталь, в области разрыхления - разрыхляющая молекулярная орбиталь. Распределение электронов по молекулярным орбиталям происходит по тем же правилам, что и распределение электронов по атомным орбиталям в изолированном атоме. Молекулярные орбитали образуются при определенных комбинациях атомных орбиталей. Их число, энергию и форму можно вывести исходя из числа, энергии и формы орбителей атомов, составляющих молекулу.
В общем случае, волновые функции, отвечающие молекулярным орбиталям в двухатомной молекуле, представляют как сумму и разность волновых функций атомных орбитале, умноженных на некоторые постоянные коэффициенты, учитывающие долю атомных орбиталей каждого атома в образовании молекулярных орбиталей (они зависят от электроотрицательности атомов):
φ(АВ) = с1ψ(А) ± с2ψ(В)
Этот метод вычисления одноэлектронной волновой функции называют "молекулярные орбитали в приближении линейной комбинации атомных орбиталей" (МО ЛКАО).
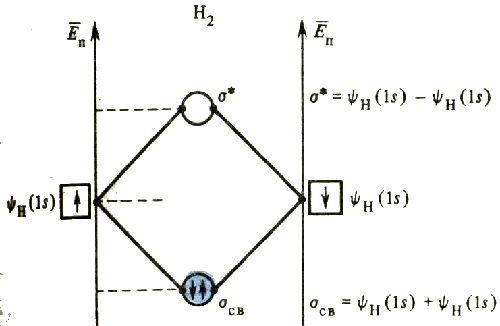
Так, при образовании иона Н2+ или молекулы водорода Н2 из двух s -орбиталей атомов водорода формируются две молекулярные орбитали. Одна из них связывающая (ее обозначают σсв), другая - разрыхляющая (σ*).
Энергии связывающих орбиталей ниже, чем энергии атомных орбиталей, использованных для их образования. Электроны, заселяющие связывающие молекулярные орбитали, находятся преимущественно в пространстве между связываемыми атомами, т.е. в так называемой области связывания. Энергии разрыхляющих орбиталей выше, чем энергии исходных атомных орбиталей. Заселение разрыхляющих молекулярных орбиталей электронами способствует ослаблению связи: уменьшению ее энергии и увеличению расстояния между атомами в молекуле. Электроны молекулы водорода, ставшие общими для обоих связываемых атомов, занимают связывающую орбиталь.

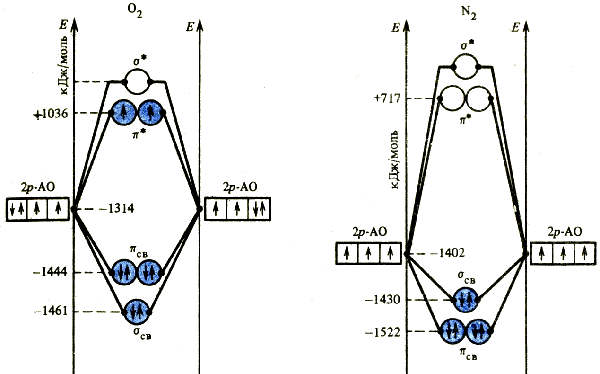
Комбинация р -орбиталей приводит к двум типам молекулярных орбиталей. Из двух р -орбиталей взаимодействующих атомов, направленных вдоль линии связи, образуются связывающая σсв- и разрыхляющая σ*-орбитали. Комбинации р -орбиталей, перпендикулярных линий связи, дают две связывающих π- и две разрыхляющих π*-орбитали. Используя при заселении электронами молекулярных орбиталей те же правила, что при заполнении атомных орбиталей в изолированных атомах, можно определить электронное строение двухатомных молекул, например O2 и N2 (рис. 35).
Из распределения электронов по молекулярным орбиталям можно рассчитать порядок связи (ω). Из числа электронов, расположенных на связывающих орбиталях, вычитают число электронов, находящихся на разрыхляющих орбиталях, и результат делят на 2 n (в расчете на n связей):
ω = [N1(число e − на связывающих МО) − N2(число e − на разрыхляющих МО)] / 2 n
Из энергетической диаграммы видно, что для молекулы Н2 ω = 1.
Метод молекулярных орбиталей дает те же значения порядка химической связи, что и метод валентных связей, для молекул О2 (двойная связь) и N2 (тройная связь). В то же время он допускает нецелочисленные значения порядка связи. Это наблюдается, например, при образование двухцентровой связи одним электроном (в ионе Н2+). В этом случае ω = 0,5. Величина порядка связи прямо влияет на ее прочность. Чем выше порядок связи, тем больше энергия связи и меньше ее длина:
| Молекула | Порядок связи | Энергия связи, кДж/моль | Длина связи, пм |
| O2 | −498 | ||
| N2 | −945 |
Закономерности в изменениях порядка, энергии и длины связи можно проследить на примерах молекулы и молекулярных ионов кислорода.
Комбинация орбиталей двух разных атомов с образованием молекулы возможно только при
близости их энергий, при этом атомные орбитали атома большей электроотрицательности на энергетической диаграмме всегда располагаются ниже.
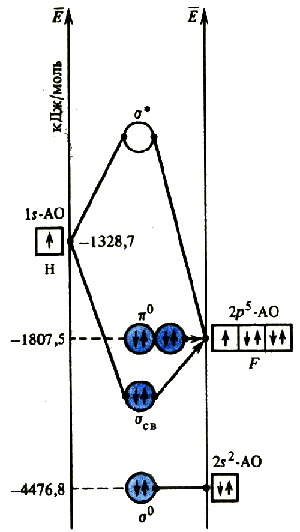 Например, при образовании молекулы фтороводорода невозможна комбинация 1 s -АО атома водорода и 1 s -АО или 2 s -АО атома фтора, так как они сильно различаются по энергии. Ближе всего по энергии 1 s -АО атома водорода и 2 p -АО атома фтора. Комбинация этих орбиталей вызывает появление двух молекулярных орбиталей: связывающая σсв и разрыхляющая σ*.
Например, при образовании молекулы фтороводорода невозможна комбинация 1 s -АО атома водорода и 1 s -АО или 2 s -АО атома фтора, так как они сильно различаются по энергии. Ближе всего по энергии 1 s -АО атома водорода и 2 p -АО атома фтора. Комбинация этих орбиталей вызывает появление двух молекулярных орбиталей: связывающая σсв и разрыхляющая σ*.
Оставшиеся 2 р -орбитали атома фтора не могут комбинироваться с 1 s -АО атома водорода, так как они имеют разную симметрию относительно межъядерной оси. Они образуют несвязывающие π0-МО, имеющие такую же энергию, что и исходные 2 р -орбитали атома фтора.
Не участвующие в ЛКАО s -орбитали атома фтора образуют несвязывающие σ0-МО. Заселение электронами несвязывающих орбиталей не способствуют и не препятствуют образованию связи в молекуле. При расчете порядка связи их вклад не учитывается.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 692; Нарушение авторских прав?; Мы поможем в написании вашей работы!