
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Многоцентровые молекулярные орбитали
|
|
|
|
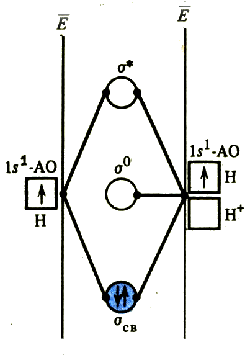 В многоцентровых молекулах молекулярные орбитали являются многоцентровыми, так они представляют собой линейную комбинацию орбиталей всех атомов, участвующих в образовании связей. В общем случае молекулярные орбитали не локализованы, то есть электронная плотность, отвечающая каждой орбитали, более или менее равномерно распределена по всему объему молекулы. Однако с помощью математических преобразований можно получить локализованные молекулярные орбитали определенной формы, соответствующие отдельным двух- или трехцентровым связям или неподеленным электронам.
В многоцентровых молекулах молекулярные орбитали являются многоцентровыми, так они представляют собой линейную комбинацию орбиталей всех атомов, участвующих в образовании связей. В общем случае молекулярные орбитали не локализованы, то есть электронная плотность, отвечающая каждой орбитали, более или менее равномерно распределена по всему объему молекулы. Однако с помощью математических преобразований можно получить локализованные молекулярные орбитали определенной формы, соответствующие отдельным двух- или трехцентровым связям или неподеленным электронам.
Простейшим примером трехцентровой связи служит молекулярный ион Н3+. Из трех s -орбиталей атомов водорода образуются три молекулярные орбитали: связывающая, несвязывающая и разрыхляющая. Пара электронов заселяет связывающую орбиталь. Образующаяся связь является двухэлектронной трехцентровой; порядок связи равен 0,5.
Химические частицы, содержащие неспаренные электроны, обладают парамагнитными свойствами (в отличие от диамагнитных свойств химических частиц, все электроны в которых спарены). Парамагнетиками являются все вещества, состоящие из химических частицы с нечетным числом электроном, например NO. Метод молекулярных орбиталей позволяет выявить парамагнетики среди веществ, состоящих из химических частиц с четным числом электронов, например О2, в молекуле которого два неспаренных электрона находятся на двух разрыхляющих π*-орбиталях.
Химические частицы с неспаренными электронами на внешних орбиталях называют свободными радикалами. Они обладают парамагнетизмом и высокой реакционной способностью. Неорганические радикалы с локализованными неспаренными электронами, например . Н, . NН2, обычно являются короткоживущими. Они образуются при фотолизе, радиолизе, пиролизе, электролизе. Для их стабилизации используют низкие температуры. Короткоживущие радикалы - промежуточные частицы во многих реакциях.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 869; Нарушение авторских прав?; Мы поможем в написании вашей работы!