
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение и свойства дисперсных систем
|
|
|
|
Лабораторная работа.
Узловые вопросы, необходимые для усвоения темы занятия.
1. Классификация дисперсных систем по степени дисперсности, агрегатному состоянию фаз.
2. Строение коллоидных частиц.
3. Методы получения и очистки дисперсных систем.
4. Свойства дисперсных систем: броуновское движение, диффузия, осмос, оптические и электрические свойства.
5. Кинетическая и агрегативная устойчивость золей. Коагуляция (скрытая и явная, медленная и быстрая).
6. Порог коагуляции, коагулирующее действие. Правило Шульце-Гарди. Взаимная коагуляция.
7. Седиментационный анализ.
8. Коллоидные ПАВ. Критическая концентрация мицеллообразования (ККМ).
7.3. Самостоятельная работа студентов.
Опыт 1. Получение гидрозоля методом замены растворителя (физическая конденсация).
К 10 мл дистиллированной воды добавьте 0,5-1 мл 2% спиртового раствора канифоли (или серы), перемешайте. Получается голубовато-желтый гидрозоль. Направьте на раствор узкий пучок света фонарика, наблюдайте и зарисуйте эффект Тиндаля.
Опыт 2. Получение золя методом гидролиза соли (химическая конденсация).
В пробирку налейте 5 мл дистиллированной воды и 0,5-1 мл 2% FeCl3, нагрейте до кипения. Получается красно-коричневый, прозрачный золь гидроксида железа, его мицелла: {Fe(OH)3 ∙n FeO+ ∙(n-x) Cl-}x+ ∙x Cl-.
Опыт 3. Получение золя берлинской лазури (реакция обмена).
А) К 1-2 мл 0,001М раствора K4[Fe(CN)6] прибавляют 2-3 капли раствора FeCl3. Получается отрицательный синий золь, его мицелла:
{m KFe[Fe(CN)6] ∙ n [Fe(CN)6]4 -∙ (4n-x)K+}x- ∙ xK+.
Какой знак заряда у частиц?
Б) К 2-3 мл раствора FeCl3 прибавьте 1-2 капли раствора K4[Fe(CN)6]. Получается зеленый золь, его мицелла:
{m KFe[Fe(CN)6] ∙ n Fe3+∙ (3n-x)Cl-}x+ ∙ xCl -.
Какой знак заряда у частиц?
Опыт 4. Определение знака зарядов коллоидных частиц.
При погружении фильтровальной бумаги в воду, бумага приобретает отрицательный заряд. Если каплю коллоидного раствора нанести на фильтровальную бумагу, то при отрицательном заряде частиц происходит пропитывание краской бумаги. При положительном заряде коллоидных частиц происходит разложение раствора на две фазы: дисперсную фазу и дисперсную среду. На этом основано определение знака заряда окрашенных коллоидных частиц. Используйте растворы метиленовой сини и эозина.

Опыт 5. Получение эмульсий.
Налейте в пробирку 2-3 мл воды, 2-3 капли углеводорода или растительного масла, встряхните. Устойчивая ли эмульсия? Добавьте в эту же пробирку 1-2 мл раствора мыла, встряхните. Запишите наблюдения. Какова роль мыла в получении эмульсии? Каков тип эмульсии: масло в воде (м/в) или вода в масле (м/в)? Нарисуйте как молекулы мыла адсорбируются на каплях масла.
Опыт 6. Определение порога коагуляции электролитов.
В коническую колбу налейте 10 мл гидрозоля Fe(OH)3 и титруйте до появления мути одним из электролитов:
1) 6М NaCl;
2) 0,01M K2SO4;
3) 0,001M K3[Fe(CN)6].
Запишите объем в мл электролита (Vэ), пошедшего на титрование. Рассчитайте порог коагуляции:
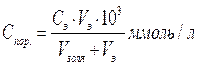
где Сэ– молярная концентрация коагулирующего электролита,
Vэ - объем (мл) электролита, вызывающего коагуляцию золя объемом Vзоля.
Для всех электролитов рассчитайте коагулирующее действие КД = 1/Спор ммоль/л. Результаты запишите в таблицу:
| Электролит | Сэ,М | Vэ,мл | Спор, ммоль/л | КД, л/ммоль |
| NaCl | ||||
| K2SO4 | ||||
| K3[Fe(CN)6]. |
Из полученных данных сделайте вывод о соответствии с правилом Шульце-Гарди: порог коагуляции обратно пропорционален заряду коагулирующего иона в шестой степени.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1016; Нарушение авторских прав?; Мы поможем в написании вашей работы!