
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Что такое структурная химия и зачем её изучать ? 2 страница
|
|
|
|
10. Опишите ту же структуру, что в задачах 07 и 08, на основе плотнейших упаковок или докажите, что она к ним не сводится.
Важнейшая особенность плотнейших упаковок – наличие гексагональных слоёв, состоящих из равносторонних треугольников, рассмотренных в задаче 09. Наша модель тетрагональная, поэтому бессмысленно искать эти слои перпендикулярно главной оси, т.е. параллельно реальным слоям структуры. Но они могут быть расположены косо. При внимательном рассмотрении можно в средней части ячейки усмотреть такие фрагменты из крупных шаров Б и Ж с атомами Ч в некоторых октаэдрических пустотах. Но эти фрагменты продолжаются бесконечно лишь в горизонтальном направлении, а в вертикальном прерываются. Поэтому структуру в целом нельзя считать основанной на плотнейших упаковках.
2 Ковалентная связь и структурная химия p–элементов
[4–с.46-100; 3–гл.10; 5]
11. Даны простейшие формулы соединений. Выберите из списка те, для которых применимо классическое понятие валентности, составьте их валентные схемы (при необходимости – несколько схем с качественной оценкой их вклада) и на основе идеи резонанса валентных схем оцените порядки и длины связей, распределение заряда по атомам.
а) CH2, NaC2H3O2, KBH4, CaCl2, Fe3C.
б) CaN2O6, MoSi2, BaSO4, B5CH6, PF3, YCl3.
в) CB2H3, NH4ClO4, BCl3, ZrB2, Ca2SiO4, C2H4O.
г) B3H5, BaCO3, P4O10, V3Si, C2NO2H5, ScF3.
д) KNbO3, NaNO3, SrCl2, BTi2, NH3O, C2B5H7.
е) SiCl4, MgCl2, Al2MgCu, N2O, Na2O2, CsB6H6.
ж) SCl2, AlF3, B2H6, N2H4, K2SO4, Al2Cu.
з) CaBr2, PBr3, BaSO4, B2H5, Cu3Au, CH4O.
и) K2PtCl6, HCNO, Li3N, AsCl3, MoSi2, MgSiO3.
к) C3H8O3, TiO2, SO2, Fe2B, Mg3N2, Na2SO3.
л) LaNi5, POCl3, KClO4, NH3O, KB3H3, Li3N
м) K2S, Na3Hg, NH4Br, NH2, BNH6, HClO4
а) Пример ответа. Классическое понятие валентности предполагает, что два атома соединяются общей электронной парой, и число таких связей – валентность атома – определяется числом неспаренных электронов в основном, возбуждённом или ионизированном состоянии. Такой подход удовлетворительно применим лишь при соблюдении двух условий (о чём часто забывают):
|
|
|
- соединяются атомы с высокой ЭО – неметаллы;
- суммарное число электронов на их валентных уровнях не меньше числа орбиталей на этих уровнях.
Если хоть одно из условий нарушается, рассуждения на основе изложенного принципа обычно ведут к ошибочным результатам.
CH2. Запись углеводорода в виде простейшей формулы непривычна, за этой формулой стоят два обширных гомологических ряда: олефины и циклопарафины. Почему же одной простейшей формулой SiO2 изображают множество разнообразных структур и считают их одним веществом – кремнезёмом? К углеводородам принцип валентности идеально применим (для них он и был выведен). Можно нарисовать множество структур, это – школьная программа.
NaC2H3O2. Это пример гетеродесмичного соединения – сочетающего разные типы связей: между атомами C, O, H – классическая ковалентная, между натрием и кислородом – типично ионная, с высокими координационными числами, которые заранее предугадать и изобразить на плоскости трудно. Поэтому грубой ошибкой будет формула, где натрий, подобно водороду, связан с одним атомом
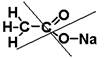 |  | ||
кислорода.
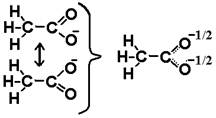
Можно уверенно нарисовать только структуру аниона, и нельзя однозначно приписать отрицательный заряд одному из атомов О. Он будет равномерно распределён между обоими. В рамках метода валентных связей это удобно представить в виде резонанса валентных схем. Каждая из двух изображённых схем удовлетворяет принципу валентности, но заряд произвольно приписан одному атому, а двойная связь – второму. Две схемы отличаются только размещением электронов, а ядра расположены одинаково. Но ведь электрон – волна, он не привязан к определённой точке. Нарисовав такие схемы, приходим к выводу, что ни одна из них не отражает правильно строение иона, истинная структура – промежуточная. Электрон распределён равномерно между обоими атомами O, а p-связь тоже делокализованная – трёхцентровая. Двухконечная стрелка на рисунке – символ не химического равновесия, а мысленной процедуры – резонанса (наложения) схем. Порядок связи С-О должен быть промежуточным между порядками в разных схемах. Если в одной из них связь простая, а в другой – двойная, причём обе схемы равноценны, то можно было бы ожидать среднего арифметического – порядка 1,5. Но эксперименты и простейшие квантовохимические расчёты методом Хюккеля показывают, что резонанс даёт дополнительное упрочнение: порядок обеих связей выше среднего арифметического (около 1,7). Это, кстати, одна из причин, объясняющих лёгкость диссоциации кислот, содержащих в анионе много концевых атомов кислорода. Не рекомендуется сразу рисовать финальную схему с пунктирами, минуя резонансные схемы, т.к. по ней трудно считать электроны, и можно ошибиться.
|
|
|
KBH4. Здесь также связь внутри аниона BH4– ковалентная, а его связь с калием – ионная и характеризуется высокими КЧ, не подчиняющимися простому принципу валентности. Связи B-H тоже обычно не подчиняются этому принципу, т.к. у атома бора на внешнем уровне электронов меньше, чем орбиталей. Но в данном случае есть добавочный электрон. Если условно приписать его атому бора, он становится четырёхвалентным, подобно атому углерода, и структуру аниона можно описывать на основе валентности, аналогично молекуле метана.
CaCl2. Соединения металлов с неметаллами не всегда являются чисто ионными, но использовать принцип валентности здесь рискованно. Формула Cl-Ca-Cl имеет смысл лишь для газовой фазы, а в твёрдом состоянии, в расплаве и в растворах КЧ кальция не менее шести, причём в водном растворе и в кристаллогидрате кальций окружен не хлором, а молекулами воды.
Fe3C. Это тоже соединение металла с неметаллом, где принцип валентности неприменим, но разница в ЭО здесь небольшая, поэтому ионная модель тоже неприменима. При таком большом содержании железа основную роль должны играть связи Fe-Fe металлического типа с высокими КЧ. Связи Fe-C тоже можно считать металлическими, и КЧ углерода может быть больше его валентности.
|
|
|
12. Не используя справочных данных, сравните указанные кислоты по силе: расположите их в порядке возрастания константы диссоциации.
| а) H3PO3, H2PO3–, H4SiO4, H3PO4; | б) Н4Р2О7, Н3Р2О7–, H5IO6, HCO3–; |
| в) H2CO3, H6TeO6, H5TeO6–, H3PO2; | г) HIO3, Н2Р2О72–, НР2О73–, Н4Р2О6; |
| д) H2SeO4, HSeO4–, HCOOH, H3IO62–; | е) H3P3O9, H2P3O9–, HBrO3, HOCl; |
| ж) HClO2, НООН, H3IO62–, H4IO6–; | з) HClO3, HSeO3–, HPO42–, HPO42–; |
| и) H2AsO4–, HAsO42–, H3AsO4, HOBr; | к) HIO4, H5IO6, HNO2, H4IO6–; |
| л) Н3Р2О7–, Н2Р2О72–, С6Н5ОН, HClO2 | м) H2SeO3, HSeO3–, HOCl, HIO3 |
Указание. С помощью резонанса валентных схем опишите строение анионов, образующихся при отрыве одного протона от указанных молекул или ионов, и определите заряд на концевом атоме кислорода, как это сделано выше для ацетат-иона. Чем больше по абсолютной величине этот заряд, тем сильнее притягивается протон, тем слабее кислота. Учтите, что во всех перечисленных случаях фосфор пятивалентен!
а) Пример решения. С учётом пятивалентности фосфора структура Н3РО3 – не Р(ОН)3, а НРО(ОН)2. В молекуле – один концевой атом О, а после отрыва одного протона концевых атомов О становится уже два, и отрицательный заряд распределяется между ними поровну: по –1/2. То же – в случае Н3РО4. Поэтому в рамках данной простой модели не видно существенной разницы между этими кислотами. Реально она есть, но небольшая: константы диссоциации отличаются лишь в два раза, а в других случаях – на 4-5 порядков величины. Фосфористая кислота даже чуть сильнее ортофосфорной, хотя традиционное описание на основе степеней окисления и «поляризующего действия» предполагает обратное.
После отрыва второго протона заряд –2 распределяется по трём концевым атомам О: по –2/3. В молекуле H4SiO4 нет концевых атомов О, и после отрыва протона заряд –1 остаётся на единственном концевом атоме О. Сравниваем с экспериментальными данными из «Справочника по аналитической химии» Ю.Ю. Лурье:
| H4SiO4 | H2PO3– | H3PO3 | H3PO4 | |
| Заряд на концевом атоме О после ионизации | –1 | –0,67 | –0,5 | –0,5 |
| Константа диссоциации в водном растворе | 1,3·10–11 | 2·10–7 | 1,6·10–2 | 7,6·10–3 |
13. Для данных молекул или ионов на основе валентных схем и теории отталкивания электронных пар валентного уровня (ОЭПВУ) предскажите форму и валентные углы с учетом возможных отклонений от идеальных значений. Обсудите факторы, влияющие на дипольный момент.
|
|
|
| а) SbCl4– | б) XeOF4 | в) C(NH2)3+ | г) TeO32- | д) NH2OH | е) SnBr3– |
| ж) IOF3 | з) TeOF2 | и) (COO–)2 | к) PBr4– | л) HSO3– | м) HSCN |
| н) As(OH)3 | о) HC(NH2)2+ | п) NH3OH+ | р) HN3 | с) POCl3 | т) H2SeO3 |
а) SbCl4– – пример решения. Сурьма – полуметалл, и к её соединениям с электроотрицательными элементами принцип валентности иногда может применяться. В данном случае, поскольку дана островная группировка, ковалентный характер связи очевиден, и можно рисовать валентные схемы. Сурьма – p-элемент пятой группы, поэтому для неё характерны валентности три и пять. Но в данном анионе есть добавочный электрон, поэтому образуется чётное число ковалентных связей. Можно считать, что атом сурьмы даёт три неспаренных электрона на "обычные" ковалентные связи с одновалентными атомами хлора, а четвёртый атом хлора несёт отрицательный заряд, т.е. имеет 8 электронов на внешнем уровне, не имеет неспаренных электронов и присоединяется по донорно-акцепторному механизму. Такая схема плоха тем, что один атом хлора считается отличным от остальных, а это ниоткуда пока не следует. Можно условно приписать добавочный электрон атому сурьмы, и тогда у него на внешнем уровне 6 электронов (как в 6-й группе), из которых четыре используются на связи с атомами хлора. Такая схема плоха тем, что отрицательный заряд приписывается менее электроотрицательному атому. Но в данном случае важен подсчёт электронов, а их реальное распределение в пространстве не обязано следовать этим схемам: они перераспределятся между атомами наиболее выгодным способом. Любое из двух рассуждений приводит к тому, что вокруг атома сурьмы – четыре связывающих пары и одна неподелённая, а всего их пять. Наиболее выгодное расположение пяти одноимённых зарядов вокруг общего центра – треугольная бипирамида (см. Приложе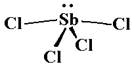 ние 1). Неподелённая пара отталкивается сильнее связывающих, и для неё выгоднее экваториальное положение; по той же причине валентные углы становятся меньше идеальных значений 90 и 120°. Можно ожидать значений 80-85 и 110-115° соответственно. Такую форму – треугольную бипирамиду без одной вершины – называют "качели" или "лодка". Позиции хлора действительно получились неэквивалентными (хотя и не в соотношении 1:3 как обсуждалось выше): электронные пары в экваториальной плоскости отталкиваются каждая от двух близких соседей, а в аксиальных положениях – от трёх. Поэтому аксиальные связи будут несколько длиннее экваториальных. Дипольный момент можно представить как векторную сумму моментов полярных связей и неподелённых пар. Группировка низкосимметричная, поэтому дипольный момент будет отличен от нуля. Отрицательно поляризованные (и несущие анионный заряд) атомы хлора расположены по одну сторону от атома сурьмы (на рисунке – снизу), и это не может полностью компенсироваться дипольным моментом неподелённой пары.
ние 1). Неподелённая пара отталкивается сильнее связывающих, и для неё выгоднее экваториальное положение; по той же причине валентные углы становятся меньше идеальных значений 90 и 120°. Можно ожидать значений 80-85 и 110-115° соответственно. Такую форму – треугольную бипирамиду без одной вершины – называют "качели" или "лодка". Позиции хлора действительно получились неэквивалентными (хотя и не в соотношении 1:3 как обсуждалось выше): электронные пары в экваториальной плоскости отталкиваются каждая от двух близких соседей, а в аксиальных положениях – от трёх. Поэтому аксиальные связи будут несколько длиннее экваториальных. Дипольный момент можно представить как векторную сумму моментов полярных связей и неподелённых пар. Группировка низкосимметричная, поэтому дипольный момент будет отличен от нуля. Отрицательно поляризованные (и несущие анионный заряд) атомы хлора расположены по одну сторону от атома сурьмы (на рисунке – снизу), и это не может полностью компенсироваться дипольным моментом неподелённой пары.
14. Дана шаростержневая модель островной группировки – молекулы или иона. Выберите из данного списка все молекулы, ионы, радикалы, которые должны иметь такую форму и обоснуйте выбор. Укажите на рисунках ожидаемые валентные углы.
| SnCl2 ClO2- HgCl2 XeF2 CN22– | SbCl3 IF3 SnCl3– ClO3– CO32– |
| AsO43– XeF4 TeF4 AsCl4– IF4– | TeF5+ IF5 AsF5 SbF52– XeF5+ |
| IO65– XeF6 TeF62– SeF6 SnCl62– |
Эта задача обратна предыдущей. Варианты – модели, которые здесь не показаны. Сравните полученную модель с теми формами, которые обеспечивают максимальное удаление электронных пар друг от друга (Приложение 1, левая половина), и станет ясно, сколько там связей и несвязывающих пар. Выберите из списка те формулы, которые подходят по соотношению компонентов, а из них – те, которые подходят по числу электронных пар вокруг центрального атома, учитывая возможность кратных связей, где две (или три) связывающие пары занимают одно место.
15. Приведите не менее трех примеров (известных или предполагаемых) молекул или ионов, изоэлектронных данной частице, укажите и объясните их форму.
а) CO32–; б) XeO3; в) N2O; г) NCO–; д) O3; е) SO42–; ж) TeCl3+; з) CN22–; и) IF4+;
к) NOF; л) СО2; м) ClO3–; н) AsO43–; о) NO2–
а) CO32–. Пример решения. Принцип изоэлектронности очень важен для ковалентных структур, как классических, так и неклассических (а иногда и для металлических систем, см. далее). Если в некоторой ковалентной структуре заменить атом на другой, отличающийся по заряду ядра на единицу и мало отличающийся по ЭО при сохранении общего числа электронов, то получится структура, сходная по геометрии, энергетике, набору спектральных линий, а часто – также по физическим и химическим свойствам (хотя, конечно, трудно сравнивать молекулы с ионами). Предсказать такую аналогию можно, даже не зная реальной структуры и принципов её строения. В данном случае кандидатами на замену углерода могут выступать его соседи бор и азот, а на замену кислорода – фтор и азот. Поскольку изменяются заряды ядер, то, чтобы сохранить изоэлектронность, должен измениться заряд. Примеры: BO33–, BF3, NO3–, CO2F–, COF2. Для описания формы достаточно рассмотреть один пример. В карбонат-ионе валентность углерода четыре, неподелённых пар не остаётся, эти валентности расходуются на три соседа (кроме трёх s-связей есть ещё делокализованная p-связь), поэтому в отталкивании участвуют три области отрицательного заряда, что ведёт к плоской форме с идеальными валентными углами по 120°. Если бы двойная связь была направлена к одному конкретному атому кислорода, углы с её участием были бы несколько больше, но здесь этого нет. Такая ситуация возникает при неравноценных соседях – во фторкарбонате, COF2, молекуле угольной кислоты.
Если увеличивать разницу в ЭО, то можно дойти до структур с большой долей ионности, где принцип изоэлектронности нарушается. Например, BeF3– формально изоэлектронен карбонат-иону, но реально не похож на него: это полимерная группировка с четверной координацией бериллия и мостиковыми атомами фтора: [BeF2F2/2–]¥.
Типичная ошибка: путают изоэлектронные структуры с неполными электронными аналогами, например, заменяют хлор фтором. Да, у них на внешнем уровне одинаковое число электронов, но эти уровни разные (третий и второй), общее число электронов тоже разное (отличается на 8), поэтому полная аналогия не обязательна.
3 Ионные и ионно-ковалентные структуры [1-гл.1 и 6; 2; 6]
16. Даны формулы бинарных соединений. Выберите из списка те, строение которых можно прогнозировать на основе ионной модели и предскажите наиболее вероятную координацию обоих компонентов. Обсудите, насколько обоснован прогноз и какие возможны отклонения. Предскажите межъядерные расстояния и обсудите возможные отклонения от прогноза и их причины.
а) AlCl3, LaF3, Fe3C, PCl3; б) P2O3, Al2O3, Be2C, Mg3N2; в) TiS2, TiBr4, ZrF4, Ti2B;
г) Cr2O3, CrO3, AsF3, Al2Cu; д) Si3N4, CS2, CaCl2, K2S; е) NF3, MgF2, CuZn, La2O3;
ж) CrF3, P2S3, NbF5, TeO2; з) CCl4, V2O3, BaO, SeS2; и) ZrCl4, TiC, BeF2, SeCl4;
к) SnS2, Sn3Nb, Li3N, Mn2O3; л) Sn2Fe3, Cr2O3, K2O, N2O3; м) Bi2O3, Cr5Al8, NbCl5, P2O5; н) TiSi2, Na3N, MnO, Mn2O7; о) SCl2, TiCl2, TiCl4, Pt2Al; п) Rb2O, N2O, LiAl, BiF3; р) SrCl2, MgCu2, Fe2O3; P2O3; с) MgZn2, VCl2, VCl4, TeCl4; т) TaC, TaCl5, Y2O3, As2O3; у) C3N4, VO, V2O5, VC; ф) LaBr3, PBr3, W2C, Cs2O; х) Fe2B, FeF3, AsCl3, CeO2
а) Пример решения. Как уже обсуждалось, Fe3C – это металлическое соединение, а PCl3 – соединение двух неметаллов – ковалентное, и применять к ним ионную модель бессмысленно. К соединениям металлов с неметаллами (AlCl3 и LaF3) её, с некоторыми оговорками, можно применять. Но как прогнозировать КЧ по ионным радиусам, если сами радиусы зависят от КЧ (см. Приложение 2)? Нет ли тут логической ошибки? Некоторые выводы всё же сделать можно. Для начала возьмём октаэдрические радиусы, которые известны для большинства элементов, а потом скорректируем прогноз. В обоих соединениях анионы и по количеству, и по размеру преобладают, поэтому КЧ будет ограничиваться касанием анионов, и для прогноза КЧ по таблице Приложения 2 нужно находить отношение радиуса катиона к радиусу аниона (в K2O было бы наоборот!).
Предположим, что Al3+ в хлориде координирован октаэдрически. Тогда его радиус 0,675 Å, а у хлора КЧ=2 из условия координационного баланса. В таблице нет радиуса Cl– для этого КЧ, но взгляд на другие анионы показывает, что у них радиус слабо зависит от КЧ, и можно взять значение около 1,62-1,64 Å. Тогда получается отношение радиусов около 0,41, т.е. пограничное между октаэдрической и тетраэдрической координацией. Можно предполагать и ту, и другую (эксперимент показывает, что в зависимости от условий бывают обе). Если у алюминия КЧ=4, то у хлора среднее КЧ=4/3=1,33. Дробного КЧ не бывает, этот результат означает, что у части атомов хлора КЧ меньше среднего, т.е. единица, а у остальных больше среднего, вероятно, два.
Для хлора с КЧ=2 мыслимы два варианта окружения Al-Cl-Al: линейное и угловое. Первое обеспечивает максимальное удаление одноимённых ионов в соответствии с ионной моделью, второе – максимальное удаление двух связывающих и двух несвязывающих электронных пар на внешнем уровне атома хлора в соответствии с ковалентной моделью. Что выбрать? Как показывает практика, в хлоридах (тем более бромидах, сульфидах) большинства металлов, кроме щелочных и щелочноземельных, окружение аниона при КЧ 2 или 3 лучше описывается теорией ОЭПВУ, хотя окружение катионов обычно следует ионной модели. В данном случае получается угловое расположение.
Средние длины связей с хорошей точностью прогнозируются суммированием шенноновских радиусов для соответствующих КЧ. Но в данном случае точных радиусов хлорид-иона при КЧ=1 и 2 нет, поэтому оценка грубая: в тетраэдре 0,53+1,61=2,14 Å, в октаэдре 0,67+1,63=2,30 Å. Но будут ли такими все расстояния? При октаэдрической координации, когда все анионы равноценны, нет видимых причин для отклонений (экспериментальные значения – в пределах 2,310-2,315 Å), а при тетраэдрической – есть. Атом хлора с КЧ=2 (мостиковый) образует две связи с валентностью по 1/2, а концевой атом хлора образует одну связь с единичной валентностью. Очевидно, она прочнее и короче. Прогнозировать длины неравноценных связей можно по формуле Полинга-Брауна, рассмотренной ниже в задаче 19.
Аналогичные рассуждения в случае LaF3 показывают, что для катиона разрешены очень высокие КЧ: 12 и более. КЧ фтора должно быть втрое меньше: 4 и более. Но можно ли в каждой вершине соединить по четыре двенадцативершинника? Рассмотрение на моделях показывает, что можно – например, при сочетании искажённых икосаэдров с искажёнными тетраэдрами. Но при больших КЧ энергетическое различие между разными КЧ сглаживается, и без детальных энергетических расчётов нельзя однозначно предсказать структуру и даже выбрать КЧ. Экспериментально найдены КЧ 9-3. Сумма ионных радиусов при таких КЧ 1,356+1,16=2,516 Å. Экспериментально найденные расстояния варьируют от 2,421 до 2,638 Å, но среднее 2,494 отличается от прогноза лишь на 0,9 %. Ионная модель предписывает при КЧ=9 и 3 трехшапочную треугольную призму и плоский треугольник, но они не могут идеально совмещаться и заметно искажены.
17. По результатам задачи 16 предскажите для тех же структур наиболее вероятную связность и обсудите, возможны ли другие варианты и почему.
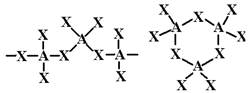
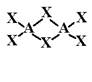 а) Пример решения. Для LaF3 при таких высоких КЧ, как 9 и 3 (тем более 12 и 4), в особенности, если учесть плоское, а не пирамидальное окружение фтора, неизбежна трёхмерная связность. Наоборот, в AlCl3 с тетраэдрической координацией алюминия есть концевые атомы хлора, и связность будет пониженной. Найдём, сколько мостиковых и концевых атомов в каждом тетраэдре AlCl4. Пусть число мостиковых атомов x, тогда число концевых 4-x. Запишем формулу так, чтобы она отражала и состав вещества, и КЧ компонентов: AlCl4-xClx/2. Атом хлора с КЧ=2 принадлежит данному тетраэдру наполовину, поэтому x делим пополам. Но это должно соответствовать составу AlCl3, поэтому 4-x+x/2=3, откуда x=2. Таким образом, в каждом тетраэдре два мостиковых атома хлора и два концевых. Посредством двух поделённых вершин тетраэдры (или другие группировки) могут соединяться вершинами в бесконечную цепь (D=1), вершинами же в цикл (D=0) или ребром в димер. В последнем случае получается очень маленький валентный угол Al-Cl-Al, т.е. сближенные катионы, но теория ОЭПВУ именно это и предсказывает. Без количественных расчётов трудно обосновать выбор одного варианта из трёх, следует допустить все. Экспериментально найден третий вариант – димер.
а) Пример решения. Для LaF3 при таких высоких КЧ, как 9 и 3 (тем более 12 и 4), в особенности, если учесть плоское, а не пирамидальное окружение фтора, неизбежна трёхмерная связность. Наоборот, в AlCl3 с тетраэдрической координацией алюминия есть концевые атомы хлора, и связность будет пониженной. Найдём, сколько мостиковых и концевых атомов в каждом тетраэдре AlCl4. Пусть число мостиковых атомов x, тогда число концевых 4-x. Запишем формулу так, чтобы она отражала и состав вещества, и КЧ компонентов: AlCl4-xClx/2. Атом хлора с КЧ=2 принадлежит данному тетраэдру наполовину, поэтому x делим пополам. Но это должно соответствовать составу AlCl3, поэтому 4-x+x/2=3, откуда x=2. Таким образом, в каждом тетраэдре два мостиковых атома хлора и два концевых. Посредством двух поделённых вершин тетраэдры (или другие группировки) могут соединяться вершинами в бесконечную цепь (D=1), вершинами же в цикл (D=0) или ребром в димер. В последнем случае получается очень маленький валентный угол Al-Cl-Al, т.е. сближенные катионы, но теория ОЭПВУ именно это и предсказывает. Без количественных расчётов трудно обосновать выбор одного варианта из трёх, следует допустить все. Экспериментально найден третий вариант – димер.
Если же рассмотреть форму с октаэдрической координацией алюминия, где у всех анионов КЧ=2, то при линейном расположении Al-Cl-Al следовало бы ожидать трёхмерной связности (каждый октаэдр обобществлял бы вершины с шестью другими), но, как обсуждалось выше, здесь выгоднее угловое расположение, октаэдры соединяются рёбрами, и каждый из них связан теперь лишь с тремя другими в пределах двумерного слоя. Чтобы представить это, можно на рисунке, приведённом в задаче 05а, убрать по одной связи у каждого аниона X.
Различием в связности определяется различие в свойствах. LaF9/3 – трёхмерный полимер, тугоплавкое, малоактивное вещество, при обычной температуре практически ни в чём не растворяется. Слоистый AlCl6/2 – тоже полимер, но легко превращается в димерные неполярные молекулы Al2Cl6, поэтому он легкоплавок, летуч, растворим в органических жидкостях и химически очень активен. Отметим, что сравнение одних только длин связей не позволяло бы сделать такой вывод: связи в хлориде алюминия короче, и, казалось бы, это вещество могло бы быть более прочным.
18. На основе структурных соображений предскажите направление обменной реакции в данной системе.
| а) Li, K || PO4, ClO4; | б) Rb, Tl || Cl, F; | в) Be, Na || NO3, OH; | г) Ca, Ba || CO3, SO4; |
| д) K, Ca || SiF6, F; | е) Li, Rb || F, Br; | ж) Pb, K || NO3, CO3; | з) Mg, K || Cl, F |
| и) Mg, K || Cl, ClO4; | к) Pb, Sr || Cl, I | л) K, Ba || F, I | м) Li, K || PF6, F |
а) Пример решения. Оба катиона имеют низкую ЭО (щелочные), в обоих анионах концевые атомы кислорода имеют высокую ЭО, поэтому связи в любой комбинации компонентов можно считать ионными, и главное различие не в характере связи, а в соотношении размеров. Не может быть стабилен ионный кристалл, где суммарный объём катионов намного больше (или намного меньше) суммарного объёма анионов, т.к. там будет много контактов одноимённых ионов. Такие вещества отличаются высокой растворимостью, низкими температурами плавления или разложения, а реакция обмена будет направлена в сторону пары солей с более благоприятными объёмными соотношениями. Этот вывод обычно справедлив и для безводных систем, и для водных растворов. Ионы PO43– и ClO4– близки по размеру – это очевидно и без справочных данных, т.к. основной объём в обоих случаях занимают четыре атома O, а центральные атомы P и Cl – соседи по периоду. Главное различие между ними – в зарядах. Таким крупным анионам для устойчивой упаковки нужно или равное число столь же крупных катионов, или большее число мелких. В системе K3PO4 + 3 LiClO4 = Li3PO4 + 3 KClO4 более благоприятные объёмные соотношения – в правой части, туда и направлена обменная реакция. Разумеется, при существенной ковалентности связи размерный фактор отойдёт на второй план: низкую растворимость AgCl и Ag2S по сравнению с NaCl и Na2S нельзя объяснить объёмными соотношениями.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 616; Нарушение авторских прав?; Мы поможем в написании вашей работы!