
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 11. Манган та його сполуки
|
|
|
|
Контрольні запитання та задачі
1. На основі електронної будови атома Хрому вказати його можливі ступені окиснення.
2. Охарактерізувати кислотно-основні властивості оксидів та гідроксидів хрому при переході від нижчих ступенів окиснення до вищих.
3. Написати молекулярні та йонні рівняння гідролізу  та
та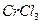 .
.
4. Внаслідок взаємодії надлишку калій йодиду з розчином калій дихромату в кислому середовищі добуто 1,005 г вільного йоду. Обчислити масу калій дихромату в розчині.
5. Закінчити рівняння реакцій, підібрати коефіцієнти методом електроного балансу:

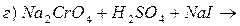
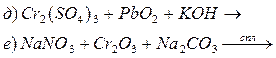
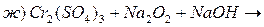
Основні теоретичні відомості
До побічної підгрупи VII групи належать елементи Манган Мn, Технецій Тс і Реній Re, які є повними електронними аналогами з конфігурацією валентних електронів (n - 1)d5ns2. Наявність у зовнішньому електронному шарі їхніх атомів лише двох електронів визначає металічну природу цих елементів.
Атоми Мангану та його аналогів утворюють хімічні зв'язки за рахунок орбіталей як зовнішнього, так і передостаннього електронного шару. Максимальна ковалентність Мангану, Технецію і Ренію дорівнює 9.
Для мангану характерні ступені окиснення +2, +4 і +7. Крім цього, існують сполуки мангану зі ступенями окиснення +3 і +6. Для ренію і технецію найхарактернішим є ступінь окиснення +7.
В елементів підгрупи Мангану, як і в елементів інших побічних підгруп, від Мn до Re збільшується стійкість сполук, у яких ці елементи виявляють вищі ступені окиснення.
Зі зростанням ступеня окиснення мангану та його аналогів тенденція до утворення цими елементами аніонних комплексних сполук зростає, а катіонних комплексних сполук — зменшується. Хімічна активність простих речовин у ряду Мn—Тс—Re послаблюється.
Манган – один з найпоширеніших елементів на Землі. Важливіша природна сполука Мангану – піролюзит МnО2·nН2О. Технецій в природі не зустрічається, його одержують штучно за допомогою ядерних перетворень з Урану. Реній самостійних родовищ не утворює. Він міститься як домішка у рудах різних металів.
Манган одержують відновленням із оксидів карбоном чи кремнієм:
МnО2 + Sі = Мn + SіО2,
МnО2 + 2С = Мn + 2СО.
У зв’язку з тим, що Мn головним чином використовують як додаток до різних сортів сталі, звичайно одержують не чистий Мn, а фероманган.
Реній виділяють із відходів переробки руд Молібдену. Для цього одержаний пер ренат калію нагрівають у струмені водню:
2КReО4 + 7Н2 = 2Re + 2КОН + 6Н2О.
Манган, Технецій та Реній — сріблясто-білі метали, тверді, стійкі проти дії води і повітря, тугоплавкі.
За хімічними властивостями Манган помітно відрізняється від Технецію та Ренію. У ряду електрохімічних потенціалів Манган розміщується до водню (між магнієм та цинком), а Технецій і Реній – після нього.
Манган досить активно взаємодіє з розбавленими розчинами кислот-неокисників (НСl, Н2SО4) з виділенням водню і утворенням солей мангану (ІІ).
Мn + 2НС1 = МnС12 + Н2↑.
Під час взаємодії з розбавленим розчином нітратної кислоти манган як активний метал відновлює HNO3 до амоній нітрату:
4Мn + 10НNО3(р) = 4Мn(NО3)2 + NН4NО3 + 3Н2О.
Концентровані кислоти – сульфатна і нітратна на холоду пасивують Мn, а під час нагрівання розчиняють його:
Мn + 2Н2SО4 = МnSО4 + SО2↑ + 2Н2О.
Технецій і Реній в розбавлених розчинах кислот не розчиняються, розчиняються тільки в кислотах-окисниках з утворенням сполук, де ці елементи виявляють найвищі ступені окиснення. Під час розчинення Тс і Re в НNО3 утворюються відповідні перренатна та пертехнецатнакислоти:
3Re° + 7НN5+О3(р) = 3НRe7+О4 + 7N2+О↑ + 2Н2О.
3Тс° + 7НN5+О3(р) = 3НТс7+О4 + 7N2+О↑ + 2Н2О.
Манган утворює такі оксиди: МnО, Мn2О3, МnО2, Мn2О7. Найстійкішим з них є МnО2, який існує в природі.
Манган (ІІ) оксид МnО одержують відновленням МnО2:
МnО2 + Н2 = МnО + Н2О,
або термічним розкладанням оксалату мангану:
МnС2О4 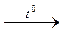 МnО + СО + СО2.
МnО + СО + СО2.
МnО основний оксид, погано розчинний у воді, добре – у кислотах:
МnО + 2НСl = МnСl2 + Н2О.
Солі мангану (ІІ) в кислому середовищі стійкі, у лужному – легко окислюються.
Під дією лугів на солі Мангану (ІІ) виділяється гідроксид Мn(ОН)2, осад білого кольору, який на повітрі швидко окислюється:
2Мn(ОН)2 + 2Н2О + О2 = 2Мn(ОН)4.
Мn(ОН)2 — основа середньої сили, дещо розчинна у воді.
Мn(ОН)2 при взаємодії з кислотами легко утворює відповідні солі. До погано розчинних солей належать карбонат, фосфат, фтори, сульфід.
Під дією сильних окисників солі мангану (ІІ) можуть окиснюватись як до МnО2, так і до МnО4-:
Mn(NO3)2 + PbO2 = MnO2 + Pb(NO3)2;
2MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O.
Остання реакція використовується в аналітичній хімії для виявлення сполук мангану, оскільки в результаті утворюються йони МnО4- з характерним фіолетовим забарвленням.
Манган (ІІІ) оксид Mn2O3 добувають нагріванням на повітрі піролюзиту до 800°С.
4MnO2 = 2Mn2O3 + О2.
Mn2O3 – основний оксид, погано розчинний у воді і кислотах.
Манган (ІІІ) гідроксид Мn(ОН)3 погано розчинний у воді, виявляє слабкі основні властивості. Солі Мангану (ІІІ), як правило, нестійкі.
MnO2 – в чистому вигляді можна добути термічним розкладанням манган (ІІ) нітрату:
Mn2+(NO3)2 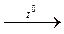 Mn4+O2 + 2N4+O2↑.
Mn4+O2 + 2N4+O2↑.
Манган (ІV) оксид MnO2 – тверда речовина, яка має забарвлення від темно-сірого до чорного і зустрічається в природі у вигляді мінералу піролюзиту. Його амфотерність виявляється слабо. На холоді манган (ІV) оксид не реагує з більшістю кислот. При нагріванні MnO2 з концентрованою сульфатною кислотою відбувається виділення кисню:
2МnО2 + 2Н2SО4(к) = 2МnSО4 + О2↑ + 2Н2О,
а з концентрованою хлоридною кислотою відбувається виділення хлору:
МnО2 + 4НС1 = МnС12 + С12↑ + Н2О.
Кислотний характер МnО2 виявляється тільки при його прожарюванні з оксидами металів чи лугами з утворенням манганатів складу Ме2МnО3 і Ме4МnО4:
МnО2 + ВаО = ВаМnО3,
МnО2 + 4 NаОН = Nа4МnО4 + 2Н2О.
Мn(ОН)4, як і відповідний йому оксид, з хімічної точки зору є амфотерним гідроксидом. Формула манган (ІV) гідроксиду Мn(ОН)4 є умовною, гідрат оксиду, який йому відповідає, має вигляд МnО2·nН2О. Гідратованому діоксиду мангану відповідають дві кислоти – метаманганітна Н2МnО4 та ортоманганітна Н4МnО4, яким відповідають солі – манганіти.
МnО2 і Мn(ОН)4 – сильні окисники. МnО2 широко застосовується як дешевий окисник у техніці і в лабораторії.
Сильні окисники переводять МnО2 у похідні Мангану (VІ) (манганати) і мангану (VІІ) (перманганати).
3МnО2 + КС1О3 + 6КОН = 3К2МnО4 + КС1 + 3Н2О;
2МnО2 + 3РbО2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2Н2О.
Манган (VІ) оксид МnО3, а також його гідрат Н2МnО4 у вільному стані не добуто.
Солі Мангану (VІ) – манганати – добувають нагріванням сполук Мn (ІІ) і Мn (ІV) у лужному середовищі при наявності окисників:
3Мn4+С12 + 2КС15+О3 + 12КОН = 3К2Мn7+О4 + 8КС11- + 6Н2О;
Мn4+О2 + 2КОН + КN5+O3 = К2Mn7+O4 + КN3+O2 + Н2О.
Манганати - сполуки яскраво-зеленого кольору, зумовленого йонами MnO42-. Манганати стійкі лише у лужному середовищі, у нейтральному та кислому середовищі диспропорціонують, як і відповідна їм манганатна кислота (Н2MnO4):
3Н2Mn6+O4 = Мn4+О2 + 2НMn7+O4 + 2Н2О,
3К2Mn6+O4 + Н2О = Мn4+О2 + 2КMn7+O4 + 4КОН.
Дією сильних окисників манганати окислюються у перманганати:
2К2Мn6+О4 + С12° = 2КМn7+О4 + 2КС11-.
Лабораторна робота
Дослід 1. Одержання та властивості манган (II) гідроксиду
Налити у пробірку 5-6 крапель розчину манган хлориду і додати такий самий об’єм розчину натрій гідроксиду. Спостерігати за утворенням білуватого осаду манган (II) гідроксиду.
Розділити одержаний осад на три пробірки. Додати в одну з них розведену сульфатну кислоту, а в другу – надлишок лугу. Пояснити, чому осад у кислоті розчиняється, а в розчині лугу – не розчиняється. Вміст третьої пробірки кілька разів збовтати і залишити на деякий час. Спостерігати поступову зміну забарвлення осаду внаслідок окиснення киснем повітря мангану (II) до мангану (IV). Написати рівняння реакцій, що відбулися.
Дослід 2. Гідроліз солей манган (II)
На смужку універсального індикаторного паперу нанести 1 краплю розчину манган (II) сульфату. Визначити рН розчину. Скласти йонне та молекулярне рівняння реакції.
Дослід 3. Відновні властивості сполук мангану (ІІ)
В пробірку внести мікрошпатель плюмбум (IV) оксиду, додати 3-4 краплі концентрованої нітратної кислоти та 1 краплю (не більш!) розчину манган (II) сульфату. Вміст пробірки нагріти. Спостерігати малинове забарвлення розчину за рахунок йонів  . Написати рівняння реакції, підібрати коефіцієнти методом електронного балансу. Це реакція якисного виявлення катіону мангана (II).
. Написати рівняння реакції, підібрати коефіцієнти методом електронного балансу. Це реакція якисного виявлення катіону мангана (II).
Дослід 4. Виявлення мангану (VII) манганом (II)
Налити у пробірку 3-4 краплі розчину манган (II) сульфату і додати краплями розчин калій перманганату. Спостерігати за знебарвленням малинового кольору і утворенням бурого осаду. Написати рівняння реакції.
Дослід 5. Термоліз калій перманганату
В пробірці нагріти декілька кристалів калій перманганату. Довести, який при цьому виділяється газ. Продовжити нагрівання до припинення його виділення. Після охолодження розчинити вміст пробірки в невеликому об’ємі води. Яке забарвлення мають отриманий розчин і осад? Написати рівняння відповідної реакції.
Дослід 6. Вплив середовища на окисні властивости перманганат-йону.
У три пробірки внести по 1-2 краплі розчину калій перманганату та додати: у першу – 3-4 краплі розведеної сульфатної кислоти, у другу – стільки ж води, у третю – 3-4 краплі розчину натрій гідроксиду. Потім у кожну пробірку додати свіжоприготований розчин натрій сульфіту. Відмітити явища, які відбуваються в кожній пробірці. Написати відповідні рівняння реакцій.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2761; Нарушение авторских прав?; Мы поможем в написании вашей работы!