
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 8. р-елементи VI групи
|
|
|
|
Основні теоретичні відомості
До головної підгрупи шостої групи належать: Оксиген О, Сульфур S, Селен Se, Телур Те і радіоактивний елемент Полоній Ро.
Атоми елементів головної підгрупи у зовнішньому електронному шарі містять s2р4-електрони. Атом Оксигену відрізняється від атомів інших елементів цієї підгрупи відсутністю d-підрівня на останньому енергетичному рівні, тому він, як правило, може виявляти ковалентність, що дорівнює двом, за винятком таких сполук, наприклад як О3, CO тощо. На відміну від Оксигену, Сульфур, Селен, Телур, Полоній можуть виявляти ковалентність не тільки два, а й чотири і шість. Це пояснюється тим, що число неспарених електронів в атомах цих елементів може збільшуватись за рахунок розпаровування s- і р-електронів з переходом їх на d-орбіталі зовнішнього електронного шару.
У разі переходу від Оксигену до Полонію радіуси їхніх атомів збільшуються, а енергія йонізації та відносна електронегативність — зменшуються. Тому найближче до металів слід розміщувати Полоній. Всі інші елементи цієї групи — неметали. Активність їх як неметалів від Оксигену до Телуру послаблюється. Одночасно від Сульфуру до Полонію послаблюється здатність виявляти негативний ступінь окиснення, який у сполуках з металами і гідрогеном, як правило, дорівнює -2.
Оксисен найпоширеніший елемент у земній корі і його вміст становить 47 мас %. Кисень – проста речовина, утворена оксисеном, міститься в атмосферному повітрі. У зв’язаному стані оксисен входить до складу води, кварцу, силікатів, алюмосилікатів, сполук тваринного та рослинного походження.
В промисловості кисень одержують фракціонною перегонкою рідкого повітря та електролізом води. У лабораторії кисень одержують за рахунок термічного або каталітичного розкладу сполук, багатих на оксисен:
2KMnO4 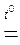 K2MnО4 + MnO2 + O2↑.
K2MnО4 + MnO2 + O2↑.
2KСlO3 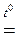 2KСl + 3O2↑.
2KСl + 3O2↑.
Оксиген виявляє широкий діапазон ступенів окиснення в сполуках. У зв’язку з тим, що атому Оксигену не вистачає двох електронів до завершення зовнішнього енергетичного рівня, він легко може приймати їх від менш електронегативних елементів, виявляючи мінімальний ступінь окиснення -2 (Н2О, КОН, Н2SО4). У пероксидах Оксиген має ступінь окиснення -1 (Н2О2, Nа2О2), в над пероксидах - 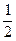 (КО2), а в озонідах -
(КО2), а в озонідах -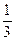 (КО3). Крім негативних, Оксиген утворює сполуки з флором із позитивними ступенями окиснення: +1(О2F2), +2(ОF2), +4(О3).
(КО3). Крім негативних, Оксиген утворює сполуки з флором із позитивними ступенями окиснення: +1(О2F2), +2(ОF2), +4(О3).
Молекула О2 досить стійка. Як і для інших р-елементів 2-го періоду, максимальна ковалентність оксигену дорівнює чотирьом.
За хімічною активністю кисень поступається лише галогенам. Він утворює сполуки з усіма елементами, за винятком легких інертних газів Не, Nе, Аr. За звичайних умов кисень не є сильним окисником. Інакше ми б не змогли спостерігати за розмаїтістю квітів та кольорів, які нас оточують. Лише при підвищеній температурі зв'язок у молекулі О2 руйнується (D 494 кДж/моль), і тоді кисень починає реагувати з усіма простими речовинами, за виключенням галогенів, інертних газів та благородних металів Аg, Аu, Рt, Rh.
4Fe + 3О2 = 2Fe2O3;
4Р + 5О2 = Р4О10;
S + О2 = SO2.
Реакції окиснення відбуваються з різною швидкістю. Повільне окиснення органічних речовин називається гниттям.
Окиснення, що відбувається з інтенсивним виділенням теплової та світлової енергії, називається горінням.
Існує не лише молекулярний Оксиген О2, а ще й озон О3, його друга алотропна форма. Озон добувають у спеціальних приладах – озонаторах:
3О2 = 2О3
У природі озон утворюється з кисню повітря під час грози, а також у розрідженній атмосфері на висоті 20 – 30 кілометрів під дією ультрафіолетових променів. Озоновий шар має неоціненне значення для розвитку життя на Землі: поглинаючи ультрафіолетові промені, він захищає все живе від згубної дії зовнішнього гамма-випромінення, а також поглинає інфрачервоні промені, що йдуть від Землі, таким чином перешкоджаючи її охолодженню.
Озон – важкий газ синього кольору, з різким запахом, отруйний. О3 – один з дуже сильних окисників, окислює золото та платину. При дії на метали утворює пероксидні сполуки. Навіть така стійка до окиснення речовина, як срібло, під дією озону перетворюється на пероксид аргентуму:
2Аg + 3О3 = Аg2О2 + 2О2.
Озон окиснює всі метали (крім золота і платинових металів) і більшість неметалів. Внаслідок взаємодії озону з лужними металами утворюються озоніди:
К + О3 = КО3.
Озон іди – сполуки до складу молекул яких входять катіони металів та озонід–йони О3-. Наявністю в йоні О3- неспареного електрона зумовлює парамагнетизм озонідів. Озон іди забарвлені в червоний колір.
Озон використовують для знезараження питної води. На відміну від обробленої хлором води, яка містить шкідливі неорганічні та органічні сполуки, озонована вода абсолютно нешкідлива для використання в народному господарстві та побуті.
Приєднуючи два електрони, молекула кисню перетворюється на пероксид-йон О22-, в якому атоми Оксигену зв’язані одним двохелектронним зв’язком. Похідні О22- називаються пероксидами.
Найбільше практичне значення з усіх пероксидів має пероксид гідрогену Н2О2. У лабораторії та медицині використовують 3%- і 30%-і розчини Н2О2 (останній називають пергідролем).
Пероксид гідрогену добувають кількома способами. Наприклад:
H2S2O8 + 2Н2О = 2H2SO4 + Н2О2.
Пероксид гідрогену відганяють від сульфатної кислоти за зниженого тиску. Пероксид гідрогену легко розкладається за реакцією самоокиснення-самовідновлення:
2Н2О2 = 2Н2О + О2.
Отже, з точки зору окисно-відновних перетворень пероксид гідрогену може виявляти властивості як окисника, так і відновника. Наприклад, у реакції:
2КІ + Na2O2 + 2H2SO4 = І2 + Na2SO4 + K2SO4 + 2Н2О
пероксид гідрогену виявляє окиснювальні властивості, а під час взаємодії з дуже сильними окисниками — відновні:
2КМnО4 + 5Н2О2 + 3H2SO4 = 2MnSO4 + 5О2↑ + K2SO4 + 8H2O.
Окисні властивості пероксидів виражені значно сильніше, ніж відновні. Водний розчин Н2О2 виявляє властивості слабкої кислоти:
Н2О2 + Н2О ↔ Н3О++ НО2-.
Оскільки під час взаємодії Н2О2 з лугами відбувається реакція:
Н2О2 + 2NaOH = Na2O2 + 2Н2О,
пероксиди металів (Na2O2, BaO2 тощо), що утворюються, можна розглядати як солі пероксиду гідрогену.
Атом Cульфуру, як і Оксигену, в зовнішньому електронному шарі містить шість електронів, два з яких є неспареними (1s22s22p63s23p43d°). В атомі Сульфуру валентними можуть бути не лише 3s- і 3р-, а й 3d-орбіталі. Тому в разі збудження атомів Сульфуру вони можуть містити до шести неспарених електронів. Максимальна ковалентність Сульфуру дорівнює шести, найстійкішими є sр3-гібридизований стан, а також sp3d -стан.
Для Сульфуру характерні такі ступені окиснення: -2 (Н2S, Nа2S, СS2); +4 (SО2, Н2SО3, NаНSО3); +6 (SО3, Н2SО4, Nа2SО4).
Важливим джерелом добування сірки є залізний колчедан, або пірит, FeS2. Під час нагрівання піриту без доступу повітря відбувається реакція розкладу:
FeS2 = FeS + S.
Сірка є типовим активним неметалом. Вона здатна сполучатися з лужними металами за кімнатної температури, а з іншими — у разі нагрівання. Такі метали, як мідь, срібло, свинець, бісмут, кадмій, ртуть тощо, мають підвищену спорідненість до сірки, тому всі вони трапляються у природі переважно у вигляді сульфідних мінералів.
У разі сполучення різних металів з сіркою утворюються сульфіди:
Ca + S = CaS;
2Cu + S = Cu2S.
Сірка за кімнатної температури активно взаємодіє з фтором. У разі слабкого нагрівання сірка здатна окиснювати багато простих і складних речовин, і водночас вона сама досить легко окиснюється киснем і галогенами. Вона може бути як окисником:
Zn + S = ZnS,
так і відновником:
S + О2 = SO2,
а також брати участь у реакціях диспропорціонування:
3S° + 6NaOH = 2Na2S2- + Na2S4+O3 + 3Н2О.
Найбільша подібність властивостей Оксигену і Сульфуру виявляється у сполуках, в яких їхні атоми мають ступені окиснення -2.
Однією з найважливіших сполук Сульфуру є гідроген сульфід Н2S (сірководень). Він утворюється при взаємодії сірки з воднем при високій температурі:
 Н2 + S Н2S
Н2 + S Н2S
У лабораторіях Сірководень добувають в апаратах Кіппа, діючи розбавленими розчинами кислот на сульфіди металів:
FeS + 2НС1 = FeCl2 + H2S↑.
Сірководень — безбарвний газ з неприємним запахом тухлих яєць. Він дуже токсичний. Сірководень легко зріджується у безбарвну рідину за температури -60,3°С. H2S горить на повітрі голубуватим полум'ям. Сірководень — сильний відновник. На повітрі він горить з утворенням оксиду сульфуру (ІV) і води:
2H2S2- + 3О2° = 2S4+O2 + 2Н2О2-.
У водному розчині H2S повільно окиснюється киснем повітря:
2H2S2- + О2° = 2Н2О2- + 2S°↓.
Сірководень здатний реагувати також з іншими окисниками, наприклад:
3H2S2- + К2Сr26+О7 + 4H2SO4 = 3S°↓ + K2SO4 + Cr23+(SO4)3 + 7Н2О;
6H2S2- + 8НСl5+O3 = 6H2S6+O4 + 8НС1-.
У воді H2S добре розчинний. Йонізація H2S, що перебуває у рідкому стані, мізерно мала. Значно краще він піддається йонізації у воді:
Н2О...H2S ↔ H3O+ + HS-.
Водний розчин H2S (сульфідна кислота) є слабкою двохосновною кислотою, яка дисоціює за двома ступенями:
H2S ↔ H+ + HS-, К1 = 6·10-8;
HS- ↔ H+ + S2-, К2= 10-14.
Солі сульфідної кислоти називаються сульфідами. Водний розчин H2S утворює два ряди солей: середні – сульфіди (Nа2S) та кислі – гідроген сульфіди (NаНS). У воді розчинні лише сульфіди лужних та лужноземельних металів, а також амонію.
У розчині сульфіди гідролізуються як солі, утворені сильною основою та слабкою двохосновною кислотою з утворенням лужного середовища:
 Na2S + Н2О NаНS + NaOН.
Na2S + Н2О NаНS + NaOН.
Сульфіди неметалічних елементів гідролізуються незворотньо, утворюючи відповідні кислоти:
SіS2 + 3Н2О = Н2SіО3↓+ 2H2S↑.
Деякі сульфіди (Аl2S3, Сr2S3, Fе2S3) також гідролізуються незворотньо з утворенням слабкої нерозчинної у воді основи та слабкої, нестійкої у водному розчині кислоти:
Аl2S3 + 6Н2О = 2Аl(ОН)3↓+ 3H2S↑.
Такі сульфіди можна одержати лише «сухим» шляхом при сплавленні металічних ошурок із сіркою, утворення їх у водному розчині неможливе.
Більшість сульфідів металів – малорозчинні сполуки, добуток розчинності яких знаходиться у межах 10-10 – 10-52. Низьку розчинність та характерне індивідуальне забарвлення, а також різну розчинність у кислотах використовують у хімічному аналізі.
Сульфіди, як похідні найнижчого ступеня окиснення Сульфуру виявляють лише відновні властивості. Продуктами їх окиснення в залежності від умов можуть бути S, SО2, Н2SО4.
Для визначення продуктів окиснення сульфідів слід пам’ятати такі закономірності:
Дією на Н2S водних розчинів більшості окисників (КMnO4, К2Сr2О7, Н2SО4(к), НNО3(к)) він окислює до вільної сірки:
5Н2S2- + 2КMn7+O4 + 3H2SO4 = 5S°↓ + 2Mn2+SO4 + К2SО4 + 8H2O.
Спалюванням сірководню в надлишку кисню утворюється SО2:
2H2S2- + 3О2° = 2S4+O2 + 2Н2О2-.
Дуже сильні окисники (Сl2, Вr2, РbО2, NаСlО, НNО3(дим)) окислюють сульфід гідрогену до сульфатної кислоти:
H2S2- + 4С12 + 4Н2О = H2S6+O4 + 8НС1.
Залежно від природи електропозитивного елемента сульфіди можуть виявляти основні, кислотні або амфотерні властивості, що яскраво простежується на прикладі реакцій гідролізу і комплексоутворення.
Основні і кислотні сульфіди взаємодіють між собою з утворенням так званих тіосолей:
Na2S + CS2 = Na2CS3.
Тіокислоти є нестійкими сполуками і розкладаються на сірководень і відповідний сульфід:
Na2CS3 + H2SO4 = Na2SO4 + H2CS3;
H2CS3 = H2S↑ + CS2↑.
Відомі кілька сполук Сульфуру з Оксигеном. Практичне значення мають дві з них: сульфур (ІV) оксид та сульфур (VІ) оксид.
Оксид сульфуру (ІV) SO2 утворюється при спалюванні сірки у повітрі:
S + O2 = SO2.
У лабораторії SO2 одержують дією концентрованої сульфатної кислоти на мідь:
Сu + 2H2SO4(к) = СuSO4 + SO2↑ + 2H2O.
або дією хлоридної кислоти на сульфіти:
Na2SO3 + 2HСl = 2NaСl + SO2↑ + H2O.
У процесі промислового виробництва сульфатної кислоти SO2 одержують випалюванням піриту:
4FеS2 + 11O2 = 2Fе2О3 + 8SO2↑
SO2 – безбарвний газ з різким запахом, отруйний, легко конденсується у рідину, що кипить за температури – 10 °С.
Сульфур (ІV) оксид добре розчиняється у воді, при цьому утворюється сульфітна кислота H2SO3.
SO2 + Н2О ↔ H2SO3.
Сульфітна кислота H2SO3 — двохосновна кислота середньої сили, дуже нестійка сполука, вона існує тільки у водних розчинах. Спроби виділити кислоту у чистому вигляді або сконцентрувати її розбавлені розчини завершуються розкладанням H2SO3 на SO2 і Н2О:
Na2SO3 + H2SO4 = Na2SO4 + SО2↑ + Н2О.
Солі сульфітної кислоти – сульфіти та гідроген сульфіти – одержують взаємодією SO2 з розчинами лугів або розчинними карбонатами:
SO2 + NaОН = NaHSO3,
SO2 + 2NaОН = Na2SO3 + Н2О,
2SO2 + Na2СО3 + Н2О = 2NaHSO3 + СО2↑.
Оскільки Сульфур в SO2 та сульфітах знаходиться у проміжному ступені окиснення (+4), ці сполуки виявляють окисно-відновну двоїстість з більш вираженими відновними властивостями.
Якщо пропускати SO2 через йодну воду, то вона миттєво знебарвлюється внаслідок відновлення І2 до І-:
SO2 + І2 + 2Н2О = H2SO4 + 2НІ.
Під час взаємодії з галогенами H2SO3, як і SO2, виявляє відновні властивості:
H2SO3 + С12 + Н2О = H2SO4 + 2НС1.
Гідроген сульфіт натрію під назвою «антихлор» використовують для видалення залишків хлору після використання його як відбілювача:
NaHSO3 + С12 + Н2О = NaHSO4 + 2НС1.
З сильними відновниками сульфітна кислота виступає окисником і відновлюється до елементарної сірки:
H2SO3 + 2H2S = 3S↓ + 3Н2О.
Під час нагрівання сульфіти піддаються диспропорціонуванню:
4Na2S4+O3 = Na2S2- + 3Na2S6+O4.
Сульфіти здатні відновлювати також вільну сірку:
Na2SO3+ S = Na2SSO3.
Na2S2O3 — сіль тіосульфатної кислоти H2S2O3 (сильна кислота) за кімнатної температури вона нестійка і розкладається на Н2О, SO2 і S. У разі підкислювання розчину Na2S2O3 відбувається реакція:
Na2S2O3 + H2SO4 = Na2SO4 + SО2↑ + S↓ + H2O.
Натрій тіосульфат — сильний відновник; він взаємодіє з хлором за реакцією:
Na2SSO3 + 4С12 + 5Н2О = 2H2SO4 + 6НС1 + 2NaCl,
а з йодом за реакцією:
2Na2S2O3 + І2 = 2NaI + Na2S4O6.
При підвищенній температурі в присутності каталізатора V2О5 оксид сульфуру (ІV) окислюється киснем до оксиду сульфуру (VІ):
2SO2 + О2 = 2SO3.
Оксид сульфуру (VІ) активно реагує з водою, утворюючи сульфатну кислоту:
SO3 + Н2О = H2SO4.
Промисловий спосіб одержання H2SO4 базується на поглинанні SO3 концентрованою сульфатною кислотою (ні в якому разі не водою), при цьому утворюється суміш полі сульфатних кислот, яку називають олеум. Склад олеуму можна представити формулою H2SO4·nSO3 (n=1-6). Олеум у перекладі з латинської «масло».
Селен Sе, Телур Те, Полоній Ро належать до р-елементів, що мають конфігурацію зовнішнього електронного шару s2р4. Селен і Телур – розсіяні, а Полоній – рідкісний елемент.
У ряду О – S – Sе – Те – Ро зменшується енергія іонізації і збільшуються розміри атомів і йонів, що зумовлює послаблення неметалічних і посилення металічних властивостей простих речовин. Так Сірка – це діелектрик, Селен і Телур виявляють як неметалічні, так і напівпровідникові і металічні властивості, а Полоній за своїми фізичними властивостями подібний до свинцю і бісмуту.
Селен і Телур у своїх сполуках виявляють такі ступені окиснення: -2 (Н2Sе, Н2Те та їхні солі – селеніди і телуриди); +4 (SеО2, ТеО2, кислоти Н2SеО3, Н2ТеО3 та їхні солі); +6 (Н2SеО4, Н2ТеО4 та їхні солі – селенати і телурати).
У ряду S – Sе – Те – Ро посилюються відновні і послаблюються окисні властивості, що підтверджується реакцією:
S° + Н2Sе2- = Н2S2- + 2Sе°.
Сірка сильніший окисник, ніж селен.
Селен з водою і розбавленими розчинами кислот не взаємодіє, а телур окислюється водою за температури 100 – 160 °С.
Те° + 2Н21+О = Те4+О2 + 2Н2°↑.
Полоній взаємодіє з НСl як типовий метал:
Ро° + 2Н1+Сl = РоСl2 + 2Н2°↑.
Концентрована нітратна кислота окислює Sе і Те до кислот, тобто телур і селен в цих реакціях ведуть себе як типові неметали:
Sе° + 4НN5+О3 = Н2Sе4+О3 + 4N4+О2 + Н2О.
Полоній за цих умов утворює солеподібні сполуки:
Ро° + 8НN5+О3 = Ро(NО3)4 + 4N4+О2 + 4Н2О.
Під час кип’ятіння в лужних розчинах селен і телур, подібно до сірки, диспропорціонують:
3Sе° + 6КОН = 2К2Sе2- + К2Sе4+О3 + 3Н2О.
Селен, телур і полоній активно взаємодіють з киснем і галогенами, під час сплавляння взаємодіють з металами.
Селен і телур з воднем утворюють відповідно селен оводень Н2Sе і телуроводень Н2Те. Це надзвичайно отруйні речовини з неприємним запахом.
Відновна активність речовин у ряду Н2S - Н2Sе - Н2Те посилюється. У водних розчинах Н2Sе і Н2Те швидко окислюється киснем повітря:
2Н2Sе + О2 = 2Sе↓ + 2Н2О.
У воді Н2Sе і Н2Те розчиняються краще, ніж Н2S, і їх розчини – сильніші кислоти, ніж Н2S.
Для Н2Sе відомі як кислі (гідрогенселеніди), так і середні (селеніди) солі, для Н2Те – тільки середні солі (телуриди).
Під час нагрівання Sе і Те з киснем утворюються кристалічні оксиди SеО2 і ТеО2. Кристалічний характер оксидів у SО2 - SеО2- ТеО2 послаблюється.
У разі взаємодії SеО2 з водою утворюється селенітна кислота Н2SеО3. ТеО2 у воді не розчиняється, в лугах розчиняється з утворенням телуридів.
На відміну від SО2 оксид селену (ІV) й оксид телуру (ІV) виявляють переважно окислювальні властивості. Так, SеО2 і ТеО2 можна відновити навіть оксидом сульфуру (ІV):
Sе4+О2 + 2S4+О2 + Н2О = Sе° + Н2S6+О4.
Н2SеО3, Н2ТеО3, Н2РоО3 як кислоти значно стійкіші, ніж Н2SО3, яка існує тільки у розчині. Всі ці кислоти утворюють два типи солей: кислі і середні. Селенітна кислота добре розчиняється у воді, Н2ТеО3 і Н2РоО3 – погано. Перевести у розчин ТеО2 і РоО2 можна під дією лугів:
ТеО2 + 2NаОН = Nа2ТеО3 + Н2О.
Солі селенітної кислоти Н2SеО3 називають селенітами, солі телуричної кислоти Н2ТеО3 – телуритами.
У ряду Н2SО3 - Н2SеО3 - Н2ТеО3 сила кислот зменшується. Телуритна кислота амфотерна.
Селенатну Н2SеО4 і телуратну Н2ТеО4 (ортотелуратну Н6ТеО6) кислоти можна добути дією сильних окисників на сполуки Sе (ІV), Те (ІV) або на прості речовини Sе і Те:
Н2Sе4+О3 + Н2О21- = Н2Sе6+О4 + Н2О,
Те° + НСl5+О3 + Н2О = Н2Те6+О4 + НСl1-.
Подібно до сульфатної кислоти, селенатна кислота Н2SеО4 сильна, малолетка, є сильним окисником. Селенати (солі Н2SеО4) за властивостями подібні до сульфатів. Солі РbSеО4, ВаSеО4 у воді не розчиняються.
Телурат на кислота – слабка. З розчину вона виділяється у вигляді кристалів ортотелуратної кислоти Н6ТеО6. Телурати – солі Н2ТеО4 і Н6ТеО6 кислот. Під час нагрівання Н6ТеО6 від її молекули відщеплюються дві молекули води і кислота перетворюється на Н2ТеО4, що є досить сильним окисником, але слабкішим, ніж Н2SеО4.
Лабораторна робота
Дослід 1. Одержання кисню
У суху пробірку насипати приблизно 0,5 г кристаличного 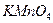 . Закріпити пробірку вертикально в лапці штатива. Газ, який при цьому виділяється, випробувати тліючою скіпкою. Написати рівняння реакції розкладу
. Закріпити пробірку вертикально в лапці штатива. Газ, який при цьому виділяється, випробувати тліючою скіпкою. Написати рівняння реакції розкладу 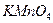 . До якого типу реакцій відноситься ця реакція?
. До якого типу реакцій відноситься ця реакція?
Дослід 2. Окисні властивості пероксиду водню
У пробірку внести 3-4 краплі розчину калій йодиду і 2 краплі розчину сульфатної кислоти. Потім додати краплями розчин пероксиду водню. Відмітити зміну забарвлення розчину. Випробувати розчин на наявність йоду за допомогою 1-2 крапель розчину крохмалю. Написати рівняння реакції.
Дослід 3. Відновні властивості пероксиду водню
У пробірку внести 1-2 краплі концентрованого 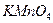 і 3-4 краплі розчину сульфатної кислоти. Потім додати краплями розчин пероксиду водню до зникнення фіолетового забарвлення розчину. Газ, який виділяється випробувати тліючою скіпкою. Написати рівняння реакції.
і 3-4 краплі розчину сульфатної кислоти. Потім додати краплями розчин пероксиду водню до зникнення фіолетового забарвлення розчину. Газ, який виділяється випробувати тліючою скіпкою. Написати рівняння реакції.
Дослід 4. Відновні властивості сульфітної кислоти та її солей
У пробірку налити 2-3 краплі розчину 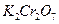 і 4-5 крапель розчину сульфатної кислоти. Потім додати краплями розчин натрій сульфіту Відмітити перехід оранжевого забарвлення в зелене. Написати рівняння реакції.
і 4-5 крапель розчину сульфатної кислоти. Потім додати краплями розчин натрій сульфіту Відмітити перехід оранжевого забарвлення в зелене. Написати рівняння реакції.
Дослід 5. Окисні властивості сульфітної кислоти та її солей
У пробірку налити 3-4 краплі розчину сульфатної кислоти та додати такий же об’єм сульфідної кислоти. Спостерігати виділення сірки.
Написати рівняння реакції.
Дослід 6. Нестійкість тіосульфатної кислоти
Внести у пробірку 5-6 крапель розчину тіосульфату натрію та додати 3-4 краплі розчину сульфатної кислоти. Відмітити утворення осаду сірки та виділення газу. Написати рівняння реакцій та графічну формулу тіосульфатної кислоти.
Дослід 7. Відновні властивості тіосульфату натрію. (Тяга!)
Внести в пробірку 5-6 крапель розчину натрію тіосульфату та додати 3-5 крапель йодної води і спостерігати за знебарвленням розчину йоду. Написати рівняння реакції, враховуючи, що йод окислює 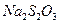 до натрій тетратіонату
до натрій тетратіонату 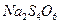 .
.
Дослід 8. Дегідратуючі властивості сульфатної кислоти
Скляною паличкою, яка змочена розчином сульфатної кислоти (1:1) зробити напис на листку фільтровального паперу, а потім підсушити папір над полум’ям пальника. Поясніть спостережувані явища, маючи на увазі, що загальна формула клітковини  .
.
Дослід 9. Окислювальні властивості концентрованої сульфатної кислоти. (Тяга!)
У пробірці нагріти до кипіння 1-2 мл концентрованої сульфатної кислоти, в яку вміщено жеврюючу деревну вуглинку. Дослідити газ, що виділяється, для чого до отвору пробірки піднести зволожений синій лакмусовий папірець. Записати рівняння реакції.
Дослід 10. Дія концетрованого і розведеного розчинів сульфатної кислоти на метали (Тяга!)
У дві пробірки внести потрохи мідних стружок, в одну з них долити 1 мл концентрованої сульфатної кислоти, у другу – стільки ж розведеного її розчину. Вміст кожної пробірки злегка нагріти, і в їх отвори внести вологий лакмусовий папірець і папірець, змочений розчином плюмбум (II) ацетату.
Записати рівняння відповідних реакцій.
Аналогічно виконати досліди з взаємодії концентрованого і розведеного розчинів сульфатної кислоти з цинком.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 774; Нарушение авторских прав?; Мы поможем в написании вашей работы!