
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 7. Нітроген та його сполуки
|
|
|
|
Контрольні запитання та задачі
1. На основі електронної будови атомів р-елементів IV групи вказати їх можливі ступені окиснення та найбільш характерні координаційні числа в сполуках.
2. Написати формули можливих оксидів та гідроксидів р-елементів IV групи та характеризувати їх кислотно-основні властивості.
3. Закінчити рівняння реакцій та підібрати коефіцієнти методом електроного балансу:
а) 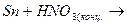 д)
д) 
б) 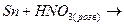 ж)
ж) 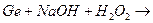
в) 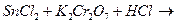 к)
к) 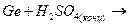
г)  л)
л) 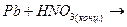
Основні теоретичні відомості
До головної підгрупи V групи належать Нітроген N, Фосфор Р, Арсен As, Стибій Sb і Бісмут Ві. Елементи побічної підгрупи V групи є металами.
Атоми елементів головної підгрупи V групи у зовнішньому електронному шарі містять s2р3-електрона. Маючи по п'ять електронів у зовнішньому електронному шарі атомів, ці елементи в цілому виявляють неметалічні властивості. Проте здатність до приєднання електронів виявлена у них значно слабкіше, ніж у галогенів і елементів головної підгрупи VI групи. Елементи головної підгрупи V групи виявляють максимальний ступінь окиснення +5, а мінімальний -3.
Із збільшенням протонного числа елемента збільшуються радіуси атомів, зменшуються енергії їх йонізації та електронегативності. Неметалічні властивості, які яскраво виявлені в Азоту, послаблюються в разі переходу до Бісмуту. Металічні властивості починають виявлятися в Арсену, Стибій приблизно однаковою мірою виявляє як металічні, так і неметалічні властивості, а Бісмут переважно виявляє металічні властивості.
У ряду N—Р—As—Sb—Ві посилюється здатність до утворення позитивно заряджених йонів, і навпаки від Бісмуту до Нітрогену зі збільшенням електронегативностей елементів посилюється їх здатність до утворення сполук з гідрогеном і металами. Сполуки з гідрогеном найлегше утворює нітроген.
Здатність до утворення сполуки зі ступенем окиснення +5 від Нітрогену до Бісмуту послаблюється.
Розпаровування s-електронів у атома Нітрогену майже виключено, тому Нітроген частіше виявляє нижчу валентність, ніж найвищу. Алотропія для Нітрогену, з цих самих міркувань, не характерна.
На зовнішньому енергетичному рівні атом Нітрогену містить 5 електронів, які розміщуються на чотирьох валентних орбіталях 2s2, 2р1х, 2р1у, 2р1z. Внаслідок відсутності d-підрівня Нітроген не може переходити у збуджений стан. У зв’язку з цим максимальна валентність Нітрогену в сполуках дорівнює 4.
Ступінь окиснення Нітрогену в його сполуках змінюється у широких межах від – 3 до +5:
| Ступень окиснення | - 3 | - 2 | - 1 | +1 | +2 | +3 | +4 | +5 | |
| Приклад сполуки | NH3, NH4+ | NH2NH2 | NH2OH | N2 | N2O | NO | N2O3, HNO2 | NO2, N2O4 | N2O5, HNO3 |
У більшості сполук Нітрогену хімічний зв'язок між атомами ковалентний, тому ступінь окиснення Нітрогену та його валентність не співпадають.
Основна маса Нітрогену зосереджена в атмосфері у вигляді простої речовини (78 об. часток %). Зв’язаний Нітроген утворює мінерали у формі нітратів: чилійська NаNО3, і індійська КNО3 і норвезька Са(NО3)2 селітра. Крім того Нітроген входить до складу білкових тіл усіх рослинних і тваринних організмів.
В техніці азот отримують фракційною перегонкою рідкого повітря.
У лабораторії азот одержують нагріванням суміші розчинів хлориду амонію і нітриту натрію. Спочатку як проміжний продукт утворюється нітрит амонію. Це термічно нестійка сполука, яка при подальшому нагріванні розкладається:
NH4Сl + NаNО2 = NH4NО2 + NаСl.
NH4NO2=N2↑ +2H2O.
Азот високого ступеня чистоти добувають термічним розкладанням азиду натрію:
2NaN3 = 3N2↑ + 2Na.
Азот можна добути також за реакціями:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O;
2N2O = 2N2 + O2;
3CuO + 2NH3 = N2 + 3Cu + 3H2O.
За звичайних умов азот — безбарвний газ, без запаху і смаку. Азот погано розчиняється у воді, не отруйний, не підтримує дихання живих організмів. Азот вважається хімічно пасивною речовиною.
Атом Нітрогену має три неспарених електрони і може утворювати три ковалентні зв'язки. У молекулі N2 атоми сполучені потрійним зв'язком, один з як є σ-зв'язком, а два інші — π-зв'язками, тому молекула N2 надзвичайно міцна.
Саме внаслідок міцності молекули азот хімічно малоактивний. За кімнатної температури він реагує тільки з літієм. У разі активації молекул N2 (нагрівання, наявність каталізатора, дія електричного розряду) азот виступає як окисник і лише у разі взаємодії з фтором і киснем — як відновник.
Атомарний азот, який можна добути під дією на N2 електричного розряду, активний навіть за кімнатної температури, він реагує з металами і неметалами з утворенням нітридів:
3Mg + N2 = Mg3N2;
2В + N2 = 2BN.
Властивості нітридів закономірно змінюються за періодами і групами періодичної системи. В малих періодах простежується перехід від основних нітридів до кислотних (Na3N — основний, A1N — амфотерний, P3N5 — кислотний).
Нітриди s-елементів І та II груп періодичної системи — кристалічні речовини, досить активні сполуки; вони легко розкладаються водою з утворенням лугу й аміаку:
Na3N + 3Н2О = 3NaOH + NH3↑.
Нітриди d-елементів — металічні сполуки. За складом вони найчастіше відповідають формулам: MeN (TiN, VN, CrN), Me2N (Nb2N, Cr2N, Mo2N) і Мe3N (Ti3N, V3N, Mo3N).
Нітроген утворює такі сполуки з Гідрогеном: аміак, гідразин, азидну кислоту, гідроксиламін.
У промисловості одержують аміак прямим синтезом з азоту та водню:
 N2 + 3Н2 2NH3.
N2 + 3Н2 2NH3.
Реакцію проводять при температурі 450 – 500°С і тиску ≈ 30МПа у присутності залізного каталізатора активованого оксидами (Аl2О3, К2О та ін.).
У лабораторних умовах аміак одержують нагріванням сумішей амоній хлориду з кальцій гідроксидом:
2NH4C1 + Са(ОН)2 = 2NH3↑ + СаС12 + 2Н2О.
У разі охолодження водного розчину аміаку можна добути кристалогідрати типу NH3·Н2О і 2NH3·Н2О.
За звичайних умов аміак безбарвний газ з рідким специфічним запахом. При вдиханні значних кількостей аміаку відбувається подразнення слизових оболонок очей та органів дихання. Аміак майже у 1,7 рази легший за повітря, 1 л його має масу 0,77 г. При охолодженні до – 33,4°С аміак скраплюється, а при – 77,8°С твердіє. Перевезти у рідкий стан аміак можна і при звичайній температурі, але при високому тиску. Легкість переходу газоподібного аміаку в рідкий стан пояснюється полярністю зв’язків N – Н в його молекулі і міцних міжмолекулярних водневих зв’язків.
Аміак – полярна речовина тому він чудово розчиняється у полярному розчиннику – воді. При 0 °С один об’єм води поглинає 1200 об’ємів газоподібного аміаку. Легка розчинність аміаку у воді пояснюється міцними водневими зв’язками, які утворюються за рахунок донарно - акцепторного механізму.
Утворені при цьому гідроксиди – іони обумовлюють лужне середовище розчину. Виходячи з низької константи дисоціації можна сказати, що гідрат аміаку NH4OH це слабка основа:
 NH3 + Н2О NH3·Н2О NH4+ + ОН-.
NH3 + Н2О NH3·Н2О NH4+ + ОН-.
Рівновага дисоціації гідрату аміаку значно зміщена ліворуч. Тому говорити про існування іонної сполуки NH4OH (гідроксиду амонію) не можна.
Концентрований водний розчин аміаку містить 25% (мас.) NH3 і має густину 0,91 г/см3.
У медичній практиці застосовують розчин аміаку з масовою часткою 10% під назвою нашатирний спирт.
У хімічному відношенні аміак досить активний. Оскільки Нітроген у NH3 має нижчий ступінь окиснення – 3, аміак виявляє тільки відновні властивості. На повітрі аміак не горить, але в атмосфері кисню він окислюється до вільного азоту:
4N3-H3 + 3О2° = 2N2° +6Н2О2-
У присутності платинового каталізатора окиснення аміаку перебігає до нітроген (ІІ) оксиду:
4N3-H3 + 3О2° = 2N2+О↑ +6Н2О2-.
Аміак виявляє відновні властивості також у реакціях з іншими окисниками. Так, розчин аміаку при нагріванні знебарвлює розчин калій перманганату:
2N3-H3 + 2КМn+7О4 = N2° + 2Мn+4О2 + 2КОН + 2Н2О
Крім реакцій окиснення, аміак вступає в реакції заміщення. Атоми гідрогену в молекулі NH3 можуть заміщуватись на атоми металів. Особливо під час взаємодії з активними металами аміак поводить себе подібно до води, під час нагрівання натрій витісняє водень з NH3:
2Na + 2NH3 = 2NaNH2 + H2↑;
2Na + NH3 = Na2NH + H2↑.
Далі може утворюватись і нітрид натрію Na3N.
Сполуки типу NaNH2, Na2NH мають сольову природу і називаються відповідно амідом та імідом натрію. Аміди лужних металів і нітриди, які утворені активними металами при кімнатній температурі гідролізуються:
 NaNH2 + H2O NaOH + NH3↑.
NaNH2 + H2O NaOH + NH3↑.
Мg3N2 + 6H2O 3Мg(ОН)2 + 2NH3
Одна з найважливіших властивостей аміаку здатність утворювати солі амонію. При взаємодії аміаку з протоном утворюється йон амонію NH4+.
NH3 + HC1 = NH4C1;
NH3 + HNO3 = NH4NO3.
Під час взаємодії з кислотами амоній гідроксид також утворює солі:
NH3 + Н2О + НС1 = NH4C1 + Н2О.
Більшість солей амонію добре розчиняється у воді. Погано розчинними є NH4C1O4, NH4ReO4. За розчинністю солі амонію подібні до солей калію.
Оскільки водний розчин аміаку є слабкою основою, то солі амонію в розчинах гідролізують. Розчини солей, утворених, аміаком і сильною кислотою мають слабко кислу реакцію:
 NH4C1 + Н2О NH3 + Н2О + НС1.
NH4C1 + Н2О NH3 + Н2О + НС1.
Солі амонію відрізняються від солей лужних металів леткістю в разі нагрівання. Солі амонію можуть розкладатися оборотно і необоротно. Оборотно розкладаються солі амонію, аніон яких не є окисником або виявляє слабкі окиснювальні властивості, наприклад:
 NH4C1 NH3 + НС1.
NH4C1 NH3 + НС1.
Солі амонію, аніони яких є окисниками, розкладаються необоротно — відбувається окисно-відновна реакція:
NH4NO3 = N2O + 2Н2О.
У цій реакції окиснюється йон амонію, а відновлюється нітрат-йон.
Крім NH3 відомі дві інші гідрогені сполуки Нітрогену - гідразин N2H4 і гідроксиламін NH2ОН. Обидві речовини важливі як для неорганічної, так і органічної хімії.
Реакція окиснення аміаку гіпохлоритом натрію відбувається з утворенням гідразину:
2NH3 +NaOCl = NaCl + N2H4 + H2O.
З водою і спиртом гідразин змішується у будь-яких співвідношеннях. Водні розчини мають лужну реакцію. З кислотами гідразин утворює два ряди солей – солі гідрозонію [N2H6]Cl2 і [N2H5]Cl. У зв’язку з тим, що в гідразин Нітроген знаходиться в проміжному ступені окиснення (-2), гідразин виявляє окисно-відновну двоїстість з перевагою відновної активності.
5N2-2H4 +4КМn+7О4 + 6Н2SО4 = 5N2° + 4Мn+2SО4 + 2К2SО4 + 16Н2О
Відновити гідразин до NH3 можна лише сильними відновниками:
Zn° + N2-2H4 + 4НСl = 2N-3H4C1 + ZnСl2
Під час взаємодії нітритної кислоти з гідразином у водному розчині відбувається окисно-відновна реакція, внаслідок якої утворюється азидна кислота:
N2H4 + HNO2 = HN3 + 2Н2О.
Гідроксиламін NH2ОН можна представити як похідне аміаку, в якому атом Гідрогену заміщений на групу ОН. Одержують гідроксиламін відновленням нітратів або нітритів:
HNO3 + 2Н2 = NH2ОН + Н2O.
Гідроксил амін з водою утворює гідрат NH2ОН·Н2O, а з кислотами - солі гідроксил амонію, наприклад [NH3ОН]Cl.
Ступінь окиснення атома Нітрогену в молекулі гідроксил аміну дорівнює – 1. Тому він може виявляти як відновні, так і окисні властивості наприклад, у реакції:
4Fe+2SО4 + 2N-1H2ОН + 3Н2SО4 = 2Fe+32(SО4)3 + (N-3H4)2SО4 + 2Н2О,
гідроксиламін виступає у ролі окисника, а в реакції:
2N-1H2ОН + І2° + 2КОН = N2° + 2КІ-1 + 4Н2O
в ролі відновника.
Азидна кислота належить до слабких кислот. Водні розчини її дисоціюють:
 HN3 Н+ + N-3.
HN3 Н+ + N-3.
Солі азидної кислоти називають азидами.
Нітроген з оксигеном утворює шість оксидів: N2O, NO, N2O3, NO2, N2O4, N2O5, в яких виявляє ступені окиснення відповідно +1, +2, +3, +4, +4, +5. Всі оксиди нітрогену за винятком N2O дуже отруйні.
Нітроген (І) оксид N2O – одержують термічним розкладанням амоній нітрату:
N-3H4N+5O3  N2+1O + 2Н2О.
N2+1O + 2Н2О.
N2O несолетворний оксид, тому в воді розчиняється мало і не взаємодіє з нею. При нагріванні N2Oлегко розкладається на азот і кисень:
2N2O = 2N2° + О2°
Нітроген (ІІ) оксид NO. Основним промисловим способом одержання NO є окиснення аміаку в присутності каталізаторів.
NO – безбарвний, малорозчинний у воді газ. Він є несолетворним оксидом, тому з водою не реагує.
Нітроген (ІІ) оксид характеризується окисно-відновною двоїстістю, однак переважаючою є відновна функція. За кімнатної температури й атмосферного тиску окиснення NO відбувається миттєво:
2NO + О2 = 2NO2.
Взаємодіючи з сильними відновниками, NO відновлюється:
2NO + 2H2 = N2 +2Н2О
Ця реакція відбувається з вибухом, оскільки виділяється велика кількість енергії.
Нітроген (ІІІ) оксид N2O3 одержують охолодженням суміші NO2 з NO.
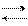 NO2 + NO N2O3
NO2 + NO N2O3
Нітроген (ІІІ) оксид – кислотний оксид, він легко поглинається лугами, утворюючи нітрити:
N2O3 + 2NaОН = 2NaNO2 + Н2О.
Внаслідок розчинення N2O3 у воді утворюється нітритна кислота НNO2. Нітритна кислота НNO2 відома лише в розчині. Це кислота середньої сили.
Нітритна кислота нестійка сполука, вона розкладається з виділенням NO і NO2.
2НN+3O2 = N+4O2↑ + N+2O + 2Н2О.
Остання реакція є реакцією самоокислення-самовідновлення, її використовують для виявлення нітрит-йонів.
Солі НNO2 називаються нітритами. Нітрити лужних і лужноземельних металів добре розчинні у воді. Всі нітрити отруйні. Нітрити, як солі слабкої кислоти легко розкладаються іншими кислотами:
NaNO2 + H2SO4 = NaHSO4 + НNO2
Нітритна кислота та її солі завдяки наявності атома Нітрогену з проміжним ступенем окиснення (+3) можуть виявляти як окисні, так і відновні властивості, наприклад:
2NaN+3O2 + 2КІ-1 + 2H2SO4 = І20 + 2N+2O + K2SO4 + Na2SO4 + 2Н2О.
Окисник
 N+3 + 1ē → N+2 1 2 окисник, пр. відновлення;
N+3 + 1ē → N+2 1 2 окисник, пр. відновлення;
2І-1 -2ē → І20 2 1 відновник, пр. окиснення;
5NaN+3O2 + 2КМn+7О4 + 3H2SO4 = 2Mn+2SO4 + 5NaN+5O3 + K2SO4 + 3H2O.
Відновник
N+3 - 2ē → N+5 2 5 відновник, пр. окиснення;
Мn+7 +5ē → Mn+2 5 2 окисник, пр. відновлення.
Нітроген (ІV) оксид NO2 – бурий газ із специфічним запахом, важчий за повітря, подразнює дихальні шляхи, дуже отруйний.
Промисловий метод одержання NO2:
2NO + О2 = 2NO2
У кислотно-основних перетвореннях NO2 поводить себе як кислотний оксид, він добре розчиняється у воді з утворенням нітратної та нітратної кислот:
2N+4O2 + Н2О = НN+3O2 + НN+5O3.
У разі взаємодії з лугами NO2 утворює нітрит і нітрат:
2NO2 + 2КОН = KNO3 +KNO2 + Н2О.
Нітроген (V) оксид N2O5 одержують дегідратацією нітратної кислоти за допомогою Р2О5, або окисненням NO2 озоном:
2HNO3 + Р2О5 = 2НРО3 + N2O5,
6NО2 + О3 = 3N2O5.
N2O5 – найсильніший окисник серед оксидів Нітрогену. Внаслідок розчинення N2O5 у воді утворюється нітратна кислота НNO3:
N2O5 + Н2О = 2НNO3.
У промисловості нітратну кислоту добувають каталітичним окисненням NH3 до NO, потім NO окиснюють киснем повітря до NO2 і суміш NO2 з надлишком повітря поглинають водою або розбавленим розчином нітратної кислоти. Сумарне рівняння цієї реакції можна записати так:
4NO2 + 2Н2О + О2 = 4HNO3.
Висококонцентрована нітратна кислота має буре забарвлення внаслідок того, що під дією світла частково розкладається з утворенням NO2, який має буре забарвлення:
4HNO3 = 4NO2↑ + О2↑ + 2Н2О.
Нітратна кислота - одна з найсильніших кислот, у розведених водних розчинах вона повністю дисоційована на йони:
HNO3 → Н+ + NO3¯.
З хімічної точки зору нітратна кислота є сильним окисником. Вона окислює більшість металів і неметалів. Неметали при дії нітратної кислоти окислюються у оксигеновмісні кислоти з вищим ступенем окиснення кислотоутворюючого неметалу, наприклад:
S° + 6НNО3 = H2S+6O4 + 6NО2 + 2Н2О,
3Р° + 5НNО3 + 2Н2О = 3H3Р+5O4 + 5NО.
Нітратна кислота взаємодіє з усіма металами (за винятком золота, платини, танталу, родію, іридію), перетворюючи їх на нітрати.
Деякі метали концентрована HNO3 пасивує. Такі метали, як Cr, Fe, A1 під дією концентрованої нітратної кислоти переходять у пасивний стан, але розчиняються в розбавленій HNO3.
Нітратні кислота може відновлюватися до різних продуктів NО2, N2O3, NО, N2O, N2 і NН4NO3.
Метали, які розташовані у ряді напруг від Н до Аu, розчиняються у концентрованій HNO3 з виділенням NО2. З розведеною нітратною кислотою процес перебігає з виділенням оксиду нітрогену (ІІ):
Сu + 4HNO3(конц.) = Сu(NO3)2 + 2NO2↑ + 2H2O,
3Аg + 4HNO3(р.) = 3АgNO3 + NO↑ + 2H2O.
Метали середньої активності (від Fе до Н) відновлюють концентровану нітратну кислоту до NO, а дуже розбавлену до NН4NO3:
3Рd + 8НNO3(p.) = 3Рd(NO3)2 + 2NО + 4H2O;
4Fе + 10НNO3(дуже р.) = 4 Fе(NO3)2 + NH4NO3 + 3H2O.
Активні метали розташовані у ряді напруг значно лівіше водню (від Zn до Lі), концентровану нітратну кислоту відновлюють до оксиду нітрогену (І):
4Са + 10НNО3(конц.) = 4Са(NO3)2 + N2O + 5H2O,
а дуже розведену НNO3 відновлюють до NН4+:
4Mg + 10НNO3(дуже p.) = 4Mg(NO3)2 + NН4NО3 + 3H2O;
Більш сильну окислювальну дію виявляє суміш концентрованих нітратної та хлоридної кислот (1:3) – «царська водка» та нітратної та фторидної кислот.
Реакції розчинення золота, платини, силіцію у суміші кислот можна подати у вигляді таких рівнянь:
Аu° + HN5+O3 + 4НСl = Н[Au3+Cl4] + N2+O↑ + 2H2O,
Pt° + 4HN5+O3 + 18НСl = 3Н2[Pt4+Cl6] + 4N2+O↑ + 8H2O,
3Si° + 4HN5+O3 + 9H2F2 = 3Н2[Si2+F6] + 4N2+O↑ + 8H2O.
Солі НNO3 – нітрати, добре розчинні у воді. Розчини нітратів мають слабкі окислювальні властивості. Цинк і алюміній у лужному розчині відновлюють нітрати і нітрити до аміаку:
4Zn + NаNO3 +7NаОН + 6H2O = 4Nа2[Zn(ОН)4] + NН3↑.
Нітрати досить стійкі при звичайних температурах, але при нагріванні розкладаються з виділенням кисню. При розкладанні нітратів металів, які розташовані у ряді стандартних електродних потенціалів зліва від магнію, утворюються нітрити металів і кисень, наприклад:
2KNO3 = 2KNO2 + О2↑,
Ва(NO3)2 = Ва(NO2)2 + О2↑.
Нітрити металів від Мg до Сu перетворюються на оксиди, наприклад:
2Сu(NO3)2 = 2СuO + 4NО2 + О2↑.
При термічному розкладі нітратів неактивних металів виділяється вільний метал:
2АgNO3 = 2Аg + 2NO2 + О2↑,
Нg(NO3)2 = Нg + 2NO2 + О2↑.
Нітрити натрію, калію, амонію і кальцію, які використовують як нітратні добрива, називають селітрами.
Фосфор досить поширений елемент (0,08 % маси земної кори). В природі він зустрічається виключно у зв’язаному стані. Найважливішими природними сполуками фосфору є мінерали фосфорит Са3(РО4)2 і апатит, який у своєму складі містить, крім Са3(РО4)2, СаF2 або СаСl2.
У вільному стані фосфор буває в кількох модифікаціях. Найбільше значення мають так звані білий і червоний фосфор.
Білий фосфор являє собою безбарвну соскоподібну речовину з жовтуватим відтінком, через що його називають також жовтим фосфором. Утворюється при швидкому охолодженні парів фосфору (tпл = 44,1°С, tкіп. = 280°С). Білий фосфор надзвичайно отруйний, легкозаймистий (tзайм. = 40°С). Практично не розчинний у воді, але добре розчинний у сірковуглеці СS2.
Червоний фосфор являє собою порошкоподібну речовину червоно-бурого кольру. Утворюється при тривалому нагріванні білого фосфору в герметично закритому посуді при температурі близько 250°С. Червоний фосфор не отруйний і в сірковуглеці не розчиняється (tзайм. = 260°С).
Чорний фосфор утворюється з білого при нагріванні його до 200-220°С при підвищеному тиску. Схожий на вигляд на графіт, жирний на дотик і важче інших видозмін, є напівпровідником.
У вільному стані фосфор одержують шляхом відновлення фосфату кальцію вугіллям в присутності діоксиду сіліцію:
Са3(РО4)2 + 3SіО2 = 3СаSіО3 + Р2О5
Р2О5 + 5С = 2Р + 5СО↑.
З киснем фосфор сполучається досить енергійно, особливо білий, виділяючи значну кількість тепла і утворюючи геміпентаоксид фосфору Р2О5:
4Р° + 5О2° = 2Р25+О52-
Фосфор легко реагує і з іншими неметалами, особливо з хлором, яким він навіть при невеликому нагріванні енергійно взаємодіє з утворенням безбарвних кристалів пентахлориду фосфору:
2Р° + 5Сl2° = 2Р5+Сl51-
При дуже високій температурі фосфор, подібно до азоту, може сполучатися з багатьма металами, утворюючи фосфіди:
2Р° + 3Са° = Са3Р23-
З воднем фосфор безпосередньо не взаємодіє. Але посереднім шляхом можне одержати сполуки фосфору з воднем:
Са3Р2 + 6НСl = 3СаСl2 + 2РН3↑.
Фосфін РН3 – безбарвний газ з запахом чеснока, дуже ядовитий, має слабо виражені основні властивості. Утворює солі лише з більш сильними кислотами (НСlО4, НСl):
РН3 + НСl = РН4Сl.
З киснем фосфор утворює кілька оксидів, з яких найважливіший Р2О5. Даний ангідрид дуже енергійно взаємодіє з водою, навіть може віднімати елементи води від інших сполук. На повітрі швидко розпливається.
При сполученні фосфатного ангідриду з водою при звичайних умовах утворюється мета фосфатна кислота:
Р2О5 + Н2О = 2НРО3.
При нагріванні молекула мета фосфатної кислоти приєднує одну молекулу води перетворюється в ортофосфатну кислоту:
НРО3 + Н2О = Н3РО4.
Ортофосфатна кислота (Н3РО4) має важливе практичне значення, її часто називають просто фосфатною кислотою. Фосфатна кислота представляє собою безбарвну кристалічну речовину (tпл = 42,35°С). У воді розчиняється дуже добре і водному розчині є кислотою середньої сили.
В промисловості її одержують при дії сульфатної кислоти на розмелений фосфат кальцію:
Са3(РО4)2 + 2Н2SО4 = 3СаSО4↓ + 2Н3РО4.
В лабораторії фосфатну кислоту можна отримати окисненням фосфору 30%-ною НNО3:
3Р + 5 НNО3 + 2Н2О = 3Н3РО4 + 5NО↑.
Солі фосфатної кислоти мають назву фосфати. Оскільки ортофосфатна кислота є триосновною, від неї походить три ряди солей, наприклад:
Н3РО4 + NаОН = NаН2РО4 + Н2О,
Н3РО4 + 2NаОН = Nа2НРО4 + 2Н2О,
Н3РО4 + 3NаОН = Nа3РО4 + 3Н2О.
Відповідно назви: перша - дигідрофосфат натрію, друга – гідрофосфат натрію, третя – нормальним фосфатом натрію.
Дигідрофосфати металів добре розчиняються у воді. Усі нормальні фосфати, за винятком фосфатів натрію, калію і амонію, у воді нерозчинні. Гідрофосфати за розчинністю у воді займають проміжне місце. Але гідро фосфати і нерозчинні у воді фосфати легко розчиняються навіть у слабких органічних кислотах.
Деякі солі ортофосфатної кислоти застосовують у сільському господарстві у якості фосфорних добрив (Са3(РО4)2, Са(Н2РО4)2, СаНРО4·nН2О, NН4Н2РО4 і т.д.).
Лабораторна робота
Дослід 1. Одержання амоніаку і вивчення його властивостей. (Тяга!)
У суху пробірку внести по мікрошпателю амоній хлориду і кальцій гідроксиду. Перемішати вміст пробірки скляною паличкою та обережно нагріти. До отвору пробірки піднести послідовно: вологу смужку червоного паперу і пояснити зміну його забарвлення та скляну паличку, змочену концентрованою хлоридною кислотою і спостерігати утворення білого нальоту амоній хлориду. Скласти рівняння реакцій одержання амоніаку; взаємодії амоніаку з водою і хлоридною кислотою.
Дослід 2. Рівновага у розчині амоніаку
У три пробірки внести 5-6 крапель розчину амоніаку і додати 1-2 краплі фенолфталеїну. Потім одну пробірку з розчином амоніаку обережно нагріти, а в другу додати амоній хлорид. Порівняти колір розчину у всіх трьох пробірках. Пояснити вплив температури і додавання 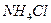 на зміщення наступних рівноваг:
на зміщення наступних рівноваг:
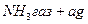
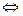
 + 8,85 ккал.
+ 8,85 ккал.
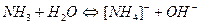
Дослід 3. Термічний розклад солей амонію. (Тяга!)
У суху пробірку внести 1 мікрошпатель амоній хлориду, обережно нагріти дно пробірки. Відмітити утворення білого нальоту у верхній частині пробірки. Написати рівняння оборотньої реакції термічного розкладу амоній хлориду.
Дослід 4. Окисно-відновні властивості нітритів (Тяга!)
а). У пробірку внести 3-4 краплі розчину калій йодиду та такий же об’єм розчину сульфатної кислоти. Потім додати 2-4 краплі розчину калій нітриту. Написати рівняння реакції, враховуючи, що нітрит-йон відновлюється до оксиду нітрогену (II).
б). У пробірку з 3-4 краплями розчину калій перманганату підкисленого 2-3 краплями розчину сульфатної кислоти, додати 2-4 краплі розчину калій нітриту. Відмітити зникнення червоно-фіолетового забарвлення перманганат-йону. Написати рівняння реакції. Зробити висновок про окисно-відновну двоїстість нітритної кислоти та нітритів.
Дослід 5. Окисні властивості нітратної кислоти. (Тяга!)
а). У суху пробірку налити 1-2 мл нітратної кислоти, нагріти під тягою. В гарячу кислоту обережно внести тліючу вуглинку. Спостерігати горіння вугілля та виділення червоно-бурого газу  . Написати рівняння реакції.
. Написати рівняння реакції.
б). У дві пробірки внести по 3-4 краплі свіжоприготованого розчину  . В одну з них додати 5 крапель концентрованої нітратної кислоти, нагріти та прокип’ятити 2-3 хв. Після охолодження додати в кожну з пробірок 2-3 краплі розчину амоній роданіду
. В одну з них додати 5 крапель концентрованої нітратної кислоти, нагріти та прокип’ятити 2-3 хв. Після охолодження додати в кожну з пробірок 2-3 краплі розчину амоній роданіду 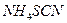 . Відмітити, в якій із пробірок міститься йон
. Відмітити, в якій із пробірок міститься йон  . Написати рівняння реакцій.
. Написати рівняння реакцій.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 7015; Нарушение авторских прав?; Мы поможем в написании вашей работы!