
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 3. Берилій. Магній. Лужноземельні метали
|
|
|
|
Основні теоретичні відомості
До головної підгрупи II групи елементів періодичної системи належать Берилій Be, Магній Mg, Кальцій Са, Стронцій Sr, Барій Ва і Радій Ra.
У зовнішньому електронному шарі атомів елементів цієї підгрупи розміщується по два валентних s-електрона, отже, ці елементи є металами.
Всі елементи головної підгрупи II групи крім Берилію мають яскраво виявлені металічні властивості. Метали головної підгрупи легко віддають свої зовнішні валентні електрони і перетворюються на катіони Ме2+. Згідно з електронною будовою, метали головної підгрупи II групи у сполуках виявляють ступінь окиснення +2, та валентність ІІ.
За величинами енергій йонізації можна зробити висновок, що активність металів зростає зі збільшенням протонного числа елементів, тобто від Берилію до Радію.
Перші два елементи підгрупи — Берилій і Магній — відрізняються від інших своїх аналогів. Берилій за властивостями подібний до Алюмінію виявляє амфотерні властивості, Магній дещо подібний до Літію, а Кальцій, Стронцій, Барій і Радій дуже подібні між собою (їх виділяють в окрему підгрупу лужноземельних металів).
Всі метали головної підгрупи II групи мають сріблястий блиск, проте блискучими залишаються на повітрі тільки Be і Mg, а лужноземельні метали швидко вкриваються плівкою оксидів та нітридів, яка не має захисних властивостей (на відміну від оксидної плівки на поверхні Be і Mg).
Барій та стронцій зазвичай зберігаються під шаром керосину або аналогічно радію в запаяних скляних трубках, тоді як інші метали цього ряду, як менш сильні відновники, можна зберігати просто в закритих склянках.
Кальцій, стронцій, барій та радій окиснюються киснем повітря, перетворюючись на білі землисті порошки оксидів, які під час розчинення у воді дають луги (звідси назва — лужноземельні). Тому лужноземельні метали доцільно зберігати під шаром органічних інертних рідин.
Всі метали головної підгрупи II групи, як дуже активні, безпосередньо сполучаються з різними неметалами (киснем, сіркою, галогенами, вуглецем, силіцієм, а деякі і з воднем).
Кальцій, стронцій та барій під час нагрівання легко реагують з воднем з утворенням гідридів МеН2.
Взаємодія з водою термодинамічно можлива практично для всіх металів:
Me + 2Н2О = Ме(ОН)2 + Н2↑.
Проте поверхня берилію вкрита дуже стійкою оксидною плівкою, що не реагує з водою навіть за температури червоного жару. Магній стійкий проти дії холодної води, але енергійно взаємодіє з киплячою водою. Кальцій, стронцій і барій реагують з водою майже з такою самою швидкістю, як і літій.
Са + 2Н2О = Са(ОН)2 + Н2↑.
Метали головної підгрупи II групи легко розчиняються у розбавлених розчинах кислот-неокисників з виділенням водню:
Be + 2НС1 = ВеС12 + Н2↑.
Під час взаємодії з розбавленим розчином HNO3 серед продуктів відновлення нітратної кислоти переважає нітрат амонію, тобто всі ці метали активні відновники:
4 Me + 10HNO3 = 4Мe(NO3)2 + NH4NO3 + 3Н2О.
Берилій здатний взаємодіяти також з лугами, чим і відрізняється від своїх аналогів:
Be + 2NaOH + 2Н2О = Na2[Be(OH)4] + Н2↑
У промисловості і в лабораторії оксиди металів головної підгрупи II групи добувають не з самих металів, а термічним розкладанням відповідних карбонатів або гідроксидів:
СаСО3 → СаО + СО2 ↑
ВаО зручно добувати нагріванням нітрату барію:
2Ba(NO3)2 = 2BaO + 4NO2 + O2↑
Оксиди кальцію, стронцію, барію, радію та дрібнокристалічний оксид магнію здатні легко сполучатися з водою з утворенням основ Ме(ОН)2, в той час як амфотерний гідроксид берилію Ве(ОН)2 добувають непрямим способом.
Оксид кальцію відомий під назвою негащене, або палене, вапно. Після гашення водою утворюється гашене вапно, яке застосовується у виробництві соди, у будівництві.
СаО + Н2О → Са(ОН)2
Гідроксиди кальцію, стронцію, барію — сильні основи, які за силою поступаються лише гідроксидам s-елементів І групи. В ряду Са(ОН)2 — Sr(OH)2 — Ва(ОН)2 зростає основний характер гідроксидів. У цьому самому напрямку посилюються їх розчинність і термічна стійкість.
Розчин Ва(ОН)2 (баритова вода) — важливий лабораторний реактив для якісного виявлення вуглекислого газу. Са(ОН)2 (вапняне молоко, гашене вапно) застосовується як дешева розчинна основа.
Крім оксидів метали головної підгрупи ІІ групи можуть утворювати й пероксиди. Найлегше утворюють пероксиди найактивніші метали.
У разі нагрівання ВаО до 600 °С за наявності кисню утворюється пероксидбарію:
2ВаО + О2 = 2ВаО2.
Більшість нітратів, хлоридів, бромідів, йодидів, ацетатів, перхлоратів металів головної підгрупи II групи розчинні у воді. До малорозчинних належать сульфати (за винятком BeSO4 і MgSO4), карбонати, оксалати, фосфати, арсенати, фториди (за винятком BeF2).
З нерозчинних солей слід відмітити карбонати МеСО3 та ортофосфати Ме3(РО4)2. Розчинність сульфатів МеSO4 зменшується від Ве до Ra; сульфати Sr, Ba, Ra практично нерозчинні; СаSO4 частково розчинний, а сульфати Ве та Мg мають високу розчинність.
Хромат барію ВаСr O4 на відміну від хромату стронцію, розчинного в оцтовій кислоті, розчиняється в соляній кислоті. Хромати мають жовте забарвлення.
Летучі солі кальцію, стронцію та барію забарвлюють полум’я газового пальника відповідно у карміново-червоне, кармінове, жовто-зелене світло.
Твердість води та методи її усунення
Вмістом у природній воді йонів Са2+ і Mg2+ зумовлена її твердість. У твердій воді не піниться мило (мило — натрієва сіль вищих карбонових кислот, наприклад стеаратної, пальмітатної тощо). Утворені за реакцією обміну кальцієві і магнієві солі цих кислот у воді не розчинні.
Під час кип'ятіння твердої води на стінках посуду (котлів) утворюється осад (накип), що складається з карбонатів кальцію і магнію — продуктів термічного розкладання розчинних у воді гідрогенкарбонатів і CaSO4·2Н2О. Розчинність CaSO4·2Н2О зменшується з підвищенням температури.
Застосування твердої води неможливе в ряді виробництв. У разі тривалого використання твердої води утворюється товстий шар накипу, який не тільки зумовлює зниження теплопровідності стінок апаратів, у яких кип'ятиться вода, а й може призвести до вибуху внаслідок перегрівання цих апаратів.
Сумарний вміст солей магнію і кальцію у воді називається її загальною твердістю.
Загальну твердість води поділяють на тимчасову, або карбонатну, і постійну, або некарбонатну.
Тимчасова твердість води зумовлена наявністю гідрогенкарбонатів кальцію і магнію, її можна усунути тривалим кип'ятінням води:
Ме(НСО3)2  МеСО3↓ + Н2О + СО2↑.
МеСО3↓ + Н2О + СО2↑.
Постійна твердість води зумовлена наявністю у воді солей сильних кислот — сульфатів і хлоридів магнію і кальцію; кип'ятінням постійну твердість води усунути неможливо.
Твердість води прийнято виражати числом міліеквівалентів (мекв) катіонів Mg2+ і Са2+, що містяться в 1 л води (1 мекв = 20,04 мг/л Са2+ або 12,16 мг/л Mg2+).
Загальна твердість води Т (мекв/л) можна обчислити за формулою:
 ,
,
де ССа2+ і СMg2+ - концентрації катіонів Са2+ і Mg2+, мг/л.
Твердість води можна обчислити за формулою:
 , [мекв/л]
, [мекв/л]
де m – маса речовини, яка зумовлює твердість води або застосовується для усунення твердості води, мг;
Ме – молярна маса еквівалентів цієї речовини, г/моль;
V – об’єм води, л.
За значенням твердості природну воду розрізняють, як дуже м’яку – з твердістю до 1,5 мекв/л; м’яку – від 1,5 до 4 мекв/л; середньої твердості – від 4 до 8 мекв/л; тверду – від 8 до 12 мекв/л і дуже тверду – понад 12 мекв/л.
Воду перед використанням зм’якшують. Існує кілька способів зм'якшення води. Тимчасову твердість усувають кип'ятінням. Якщо ж вода містить багато гідрогенкарбонатів, то її зм'якшують добавлянням гашеного вапна, яке переводить кислі солі у середні:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О.
Якщо твердість зумовлена наявністю сульфатів і хлоридів кальцію, магнію, то до води додають соду Na2CO3 або Са(ОН)2. У цьому разі осаджуються всі солі магнію і кальцію у вигляді СаСО3 і Mg(OH)2. Замість соди для зм'якшення води іноді використовують ортофосфат натрію або поліметафосфат натрію. Ортофосфат осаджує йони Са2+ і Mg2+, поліметафосфат утворює з ними розчинні комплексні сполуки, які не дають накипу і не послаблюють мийну дію мила.
Усунути твердість води можна також методом йонного обміну або катіонуванням. Для цього тверду воду слід пропустити крізь шар катіоніту, який здатний обмінювати йони Na+ або Н+ на Са2+ і Mg2+:
Ca2+ + Na2R = 2Na+ + CaR,
Mg2+ + Na2R = 2Na+ + MgR.
Оскільки ця реакція оборотна, то катіоніт легко піддається регенерації. Для цього крізь катіоніт достатньо пропустити концентрований розчин NaCl, і його знову можна буде використовувати.
Іноді воду потрібно очищати не тільки від йонів Са2+ і Mg2+, а й від інших йонів. У цьому разі ефективнішим є застосування органічних йонітів спочатку в Н+ -формі, а потім в ОН- - формі (Н-катіоніти та ОН-аніоніти). Під час проходження води крізь Н-катіоніти та ОН-аніоніти вона очищається від усіх солей взагалі, тобто таким способом її можна перетворити на дистильовану. Така обробка води називається знесолюванням.
Для регенерації Н+-катіоніту його слід обробити хлоридною або сульфатною кислотою. Внаслідок цього йони Са2+, Mg2+ переходять у розчин, а катіоніт знову насичується йонами Н+. Для регенерації аніоніту його слід обробити розчином лугу; у цьому разі увібрані аніони будуть витіснятися у розчин, а аніоніт насичуватиметься йонами ОН-.
Найм'якша вода у природі — це дощова та снігова.
Лабораторна робота
Дослід 1. Відновні властивості Магнію та Кальцію
а). Взаємодія магнію та кальцію з водою.
Шматочок магнію, очищений наждачним папіром, занурити у пробірку з 5-6 краплями дистильованої води і додати 1-2 краплі фенолфталеїну. Відмітити відсутність перебігу реакції при комнатнії температурі. Нагріти пробірку. Спостерігати утворення бульбашок газу на поверхні металу. Відмітити зміну кольору розчину.
Аналогічний дослід провести з металічним кальцієм.
Написати рівняння відповідних реакцій та визначити, при яких умовах вони протікають.
б). У дві пробірки помістити окремо шматочок металічного магнію та кальцію і додати 5-6 крапель розведеної хлоридної кислоти.
Написати рівняння реакцій.
Дослід 2. Оксиди та гідроксиди магнію і кальцію
У дві пробірки помістити окремо по 1 мікрошпателю оксидів магнію і кальцію, додати в кожну з них по 1 мл дистильованої води та 1-2 краплі фенолфталеїну. Розмішайте скляною паличкою. Відмітить погану розчинність оксиду магнію у воді.
Який з гідроксидів має найбільш лужні властивості?
Дослід 3. Властивості магній гідроксиду
Налити у пробірку 3 краплі розчину магній хлориду і додати такий самий об’єм розведеного розчину натрій гідроксиду. Спостерігати за утворенням білого драглистого осаду. Розділити осад на дві пробірки. В окремих пробірках подіяти на осад надлишком лугу і розведеною хлоридною кислотою. Зробити висновок про хімічний характер магній гідроксиду. Написати рівняння реакцій.
Дослід 4. Солі лужноземельних металів.
а). Сульфати.
У три пробірки налити по 3-5 крапель розчину натрій сульфату 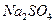 . В одну з них додати такий же об’єм розчину
. В одну з них додати такий же об’єм розчину , в другу -
, в другу -  , в третю -
, в третю -  . В яких пробірках утворився осад нерозчинного сульфату? Написати рівняння реакцій.
. В яких пробірках утворився осад нерозчинного сульфату? Написати рівняння реакцій.
б). Хромати.
У три пробірки налити окремо по декілько крапель розчинів  ,
,  і
і  та додати в кожну з них по декілька крапель розчину калій хромату. В розчинах яких солей утворюється осад і яке його забарвлення? Додати до осадів 5-6 крапель розчину ацетатної кислоти. Усі чи ні осади розчинюються? Можливо чи ні в присутності ацетатної кислоти осадити хромат-йоном йони стронцію?
та додати в кожну з них по декілька крапель розчину калій хромату. В розчинах яких солей утворюється осад і яке його забарвлення? Додати до осадів 5-6 крапель розчину ацетатної кислоти. Усі чи ні осади розчинюються? Можливо чи ні в присутності ацетатної кислоти осадити хромат-йоном йони стронцію?
Дослід 5. Реакція виявлення катіонів Магнію 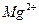
У пробірку з 2 краплями розчину магній хлориду додати равний об’єм розчину амоніаку до випадіння осаду. Далі додавати краплями розчин амоній хлориду до повного розчинення осаду, а потім до прозорого розчину суміші доліти 2-3 краплі натрію гідрогенфосфату. Спостерігати за випаданням білого кристалічного осаду магнію-амонію  . Написати рівняння реакції.
. Написати рівняння реакції.
Дослід 6. Забарвлення полум’я солями лужно-земельних металів
Очищену шляхом промивання в хлоридній кислоті і прожарювання ніхромову проволоку внести у розчин солі кальцію, а потім в полум’я паяльника. Спостерігати забарвлення полум’я. Те ж саме виконати з солями Стронцію та Барію.
Ніхромову проволоку після кожної солі промити у хлоридній кислоті і прожарити до повного зникнення забарвлення полум’я.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2036; Нарушение авторских прав?; Мы поможем в написании вашей работы!