
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 4. Бор та алюміній
|
|
|
|
Контрольні запитання та задачі
1. Охарактерізовати зміну кислотно-основних властивостей оксидів:
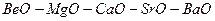 .
.
2. Указати який із S-елементів II групи має амфотерні властивості. Підтвердити його амфотерність відповідними рівняннями реакцій.
3. Присутність яких солей обумовлюють твердість природної води? Які хімічні реакції протікають при додаванні до твердої води: а)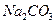 ; б)
; б) 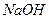 ; в)
; в) 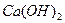 ?
?
4. Чому дорівнює твердість води, якщо в 5 л її міститься 3 г кальцій хлориду?
5. Скільки грамів соди необхідно додати до 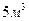 води, щоб усунути її твердість, яка дорівнює 2,5 мекв/л?
води, щоб усунути її твердість, яка дорівнює 2,5 мекв/л?
6. Закінчити рівняння реакцій
а)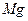 +
+ 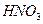 (розб)
(розб) 
б) 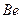 +
+ 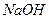 +
+ 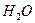

в) 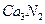 +
+ 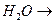
г) 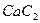 +
+ 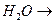
д) 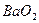 +
+ 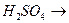
ж) 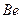 +
+ 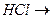
7. Здійснити послідовні перетворення, назвати сполуки:
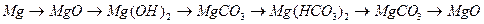 .
.
8. Скільки негашеного вапна можно добути з 1 т. вапняку, який містить 88% кальцій карбонату?
Основні теоретичні положення
До елементів головної підгрупи III групи належать Бор В, Алюміній А1, Галій Ga, Індій In, Талій Т1.
В атомах елементів головної підгрупи в зовнішньому електронному шарі міститься по три електрони: ns2np1. Всі вони за виключенням бору, за хімічними властивостями є металами і втрачають при окиснені 3 електрони за схемою:
Ме – 3е- =Ме3+.
У сполуках всі елементи головної підгрупи виявляють ступінь окиснення +3, валентність 3. Проте, вони можуть виявляти і нижчий ступінь окиснення +1; ця здатність від Бору до Талію підвищується. Так, для Талію найстійкішими є сполуки зі ступенем окиснення його +1.
Металічні властивості цих елементів помітно посилюються зі зростанням протонних чисел їхніх атомів. Проте вони виявлені слабкіше, ніж у відповідних елементів головних підгруп І і II груп.
Бор відрізняється від інших елементів своєї підгрупи. Він більш подібний до неметалів ніж до металів. Незважаючи на те, що його атом у зовнішньому електронному шарі містить мало електронів, вони важко відщеплюються, оскільки розміщені близько до ядра. Бор перебуває у 2-му періоді на межі між металами і неметалами. У цьому разі виявляється аналогія властивостей елементів по діагоналі періодичної системи.
Посилення металічних властивостей із зростанням протонного числа елементів виявляється у властивостях їхніх оксидів і гідроксидів. Так, оксид бору має кислотний характер і є ангідридом боратної кислоти, оксиди і гідроксиди алюмінію, галію й індію — амфотерні, оксид і гідроксид талію(Ш) мають основний характер.
Найбільше практичне значення з усіх елементів головної підгрупи III групи мають Бор і Алюміній.
Бор – перший р -елемент у періодичній системі. В незбудженому стані атом бору має будову зовнішнього електронного шару 2s22р1. Бор існує в аморфній (коричневій) та кристалічній (чорній) формах. Обидві модифікації бору не здатні до взаємодії з водою та кислотами-неокисниками.
Бор під час нагрівання реагує з концентрованими розчинами Н2SО4 і НNО3, з царською водкою.
Для розчинення аморфного бору найкраще використовувати концентровану нітратну кислоту, яка відновлюється до нітроген (ІV) оксиду відповідно до рівняння:
В + 3HN5+O3 = H3B3+O3 + 3N4+O2
В атмосфері кисню бор та алюміній горять, утворюючи В2О3 і Al2О3.
4В + 3О2 = 2 В2О3
4Al + 3О2 = 2 Al2О3
Елементарний бор є неметалом, він, окрім відновлюючих властивостей, має також окислювальні властивості. З деякими металами він енергійно взаємодіє при нагріванні, утворюючи бориди:
3Mg + 2B = Mg3B2
Борний ангідрид утворює ряд борних кислот: ортоборну Н3ВО3, метаборну НВО2 і полі борні кислоти загальною формулою (В2О3)х·(Н2О)у, з яких найбільш простою по складу є тетраборна кислота Н2В4О7. Всі кислоти бору слабкі електроліти. У водному розчині найбільш стійкою є Н3ВО3, інші кислоти взаємодіючи з водою утворюють ортоборну:
НВО2 + Н2О = Н3ВО3
Н2В4О7 + 5Н2О = 4Н3ВО3
Найбільш стійкою сіллю борної кислоти є тетроборат натрію або бура. Бура – це великі безбарвні кристали складу Nа2В4О7∙10Н2О, що утворюється під час взаємодії боратної кислоти з гідроксидом натрію.
4Н3ВО3 + 2NаОН = Nа2В4О7 + 7Н2О
Водні розчини бури внаслідок гідролізу мають сильно лужну реакцію:
Nа2В4О7 + 7Н2О ↔ 4Н3ВО3 + 2NаОН.
При взаємодії бури з сильними кислотами утворюється борна кислота відповідно до рівняння:
Nа2В4О7 + 2НСl + 5Н2О = 4Н3ВО3 + 2NаСl
Прокалювання бури супроводжується спучуванням кристалів внаслідок виділення кристалізаційної води:
Nа2В4О7·10 Н2О = 10 Н2О + Nа2В4О7
Розплавлена бура розчинює оксиди металів з утворенням найбільш термічно стійких солей – метаборатів:
СоО + Nа2В4О7 = 2 NаВО2·Со(ВО2)2
Борний ангідрид при сплавлені також легко розчинює оксиди металів, утворюючи метаборати:
СоО + В2О3 = Со(ВО2)2
Більшість мета боратів забарвлені в різні кольори. Цю властивість їх використовують при отриманні забарвлених «борних стекол» чи «перлів бури», які використовують у хімічному аналізі.
Всі летучі сполуки бору забарвлюють полум’я пальника в яскраво – зелений колір. Крапля розчину борної кислоти залишає на жовтому куркумовому папері червону пляму, що переходить в зелено-чорну при змочуванні розчином лугу.
Алюміній це сріблястий метал, м’який і пластичний, добре кується, витягується в дріт. На повітрі він вкривається дуже тонкою плівкою Al2О3, яка характеризується високою міцністю та щільністю.
Алюміній – амфотерний елемент. На відміну від бору, для нього характерні не тільки аніонні, а й катіонні комплекси.
Металічний алюміній, поверхня якого вкрита захисною плівкою Аl2О3, не реагує з водою. Якщо ж цю плівку зруйнувати, наприклад амальгамуванням, то відбуватиметься енергійна взаємодія алюмінію з водою з виділенням водню:
2Аl + 6H+OH = 3H02 + 2Al3+(OH)3
Оскільки алюміній амфотерний, він розчиняється в розбавлених розчинах кислот і лугів з утворенням гексааквакатіонних [Аl(Н2О)6]3+ та гексагідроксоалюмінат – аніонних [Аl(ОН)6]3- комплексів:
2Аl + 6НСl + 12 Н2О = 2[Аl(Н2О)6]Сl3 + 3Н2↑;
2Аl + 6NаОН + 6 Н2О = 2Nа3[Аl(ОН)6] + 3Н2↑.
Проте дуже розбавлені і дуже концентровані розчини нітратної і сульфатної кислот на алюміній практично не діють – відбувається пасивація й оксидна плівка алюмінію зміцнюється. В помірно концентрованих розчинах цих кислот алюміній розчиняється.
Під час нагрівання алюмінію оксидна плівка тріскається, тому в атмосфері кисню алюміній займається, енергійно взаємодіючи з ним:
4 Аl + 3О2 = 2Аl2О3
Аl2О3 – амфотерний оксид.
Під час сплавляння Аl2О3 з карбонатами і гідроксидами утворюються відповідні мета- та ортоалюмінати:
Аl2О3 + 2NаОН = 2NаАlО2 + Н2О;
Аl2О3 + СаСО3 = Са(АlО2)2 + СО2↑.
Гідроксид алюмінію Аl(ОН)3 можна добути, діючи на розчини солей алюмінію лугами:
АlСl3 + 3NаОН = Аl(ОН)3↓ + 3NаСl.
Як і оксид, Аl(ОН)3 – амфотерний. Свіже добутий гідроксид алюмінію легко розчиняється у кислотах і лугах:
Аl(ОН)3 + 3НСl + 3Н2О = [Аl(Н2О)6]Сl3
Аl(ОН)3 + 3NаОН = Nа3[Аl(ОН)6].
Відомі дві алюміневі кислоти ортоалюмінева Н3АlО3 та метаалюмінева НАlО2. Солі останньої утворюються при сплавлінні її (або оксиду) з лугами, наступним чином:
НАlО2 + NаОН = NаАlО2 + Н2О.
Гідроксид алюмінію має високі адсорбційні властивості і використовується для очищення води і як протрава при фарбуванні.
Алюміній здатен енергійно взаємодіяти з галогенами з утворенням розчинних у воді галогенідів.
Солі алюмінію утворені слабкими кислотами (сульфід, карбонат тощо) повністю гідролізуються, тому під дією (NН4)2S на водні розчини солей алюмінію виділяється не сульфід алюмінію Аl2S3, а гідроксид алюмінію Аl(ОН)3:
АlСl3 + 3(NН4)2S + 6 Н2О = 2 Аl(ОН)3↓ + NН4Сl + 3Н2S↑
Досить поширеними солями алюмінію та оксигеновмісних кислот є нітрати, перхлорати, сульфати, які добре розчиняються у воді, під час кристалогідрації утворюють кристалогідрати: Аl(СlО4)3·9 Н2О, Аl(NО3)3·4Н2О, Аl2(SО4)3·18 Н2О.
Сульфат алюмінію застосовується для очищення води. Внаслідок перебігу реакції:
Аl2(SО4)3 + 3Са(НСО3)2 = 3СаSО4 + 2 Аl(ОН)3↓ + 6СО2
утворюються пластівці гідроксиду алюмінію, які, осідаючи, захоплюють різні домішки.
Лабораторна робота
Дослід 1. Отримання ортоборної кислоти з тетраборату натрію (бури)
У суху пробірку внести 1-2 мікрошпателя тетраборату натрію  , розчинити його у 10 краплях дистильованої води та нагріти на полум’ї пальника до зникнення кристалів. До одержаного насиченого розчину додати 2-3 краплі концентрованої сульфатної кислоти. Охолодити пробірку з сумішшю під краном. Відмітити колір утворених кристалів ортоборної кислоти. Написати рівняння реакції. Пояснити, чому сульфатна кислота витисняє борну кислоту.
, розчинити його у 10 краплях дистильованої води та нагріти на полум’ї пальника до зникнення кристалів. До одержаного насиченого розчину додати 2-3 краплі концентрованої сульфатної кислоти. Охолодити пробірку з сумішшю під краном. Відмітити колір утворених кристалів ортоборної кислоти. Написати рівняння реакції. Пояснити, чому сульфатна кислота витисняє борну кислоту.
Дослід 2. Виявлення Бору в сполуках
У фарфорову чашку внести декілька кристалів ортоборної кислоти, додати 1-2 краплі концентрованої сульфатної кислоти та 5-6 крапель етилового спирту. Перемішати суміш скляною паличкою та підпалити. Звернути увагу на забарвлення полум’я етилового естеру ортоборної кислоти. Записати відповідне рівняння реакції.
Дослід 3. Добування “перлів” бури
Кінец платинового дротика прожарити у зовнішній зоні полум’я пальника занурити у порошок бури і знову прожарити в полум’ї пальника до утворення прозорового скельця. Після охолодження скельце змочити розчином солі кобальту (або солі хрому) і прожарити до утворення прозорих забарвлених “перлів” бури. Записати рівняння реакцій.
Дослід 4. Взаємодія алюмінію з водою
Алюмінієвий дротик зачистити наждачним папером та помістити один кінець в пробірку з водою. Через деякий час спостерігати виділення бульбашок газу. Написати рівняння реакції взаємодії алюмінію з водою. При яких умовах можлива ця реакція?
Дослід 5. Відношення алюмінію до кислот і луг.
(Дослід проводити у витяжній шафі)
У три сухі пробірки помістити приблизно однакові шматочки алюмінію і додати в першу 5-6 крапель розчину концентрованої хлоридної кислоти, в другу – 5-6 крапель розчину концентрованої нітратної кислоти. Чи відбувається розчинення алюмінію у концентрованій нітратній кислоті на холоді? Обережно нагрійте пробірку. Який газ при цьому виділяється? В третю пробірку додати 5-6 крапель 30% розчину натрій гідроксиду, нагріти пробірку. Спостерігати виділення газу. Написати рівняння відповідних реакції.
Дослід 6. Амфотерність алюміній гідроксиду
У дві пробірки налити по 2-3 краплі розчину алюміній сульфату та додати краплями розчин натрій гідроксиду до утворення осаду. Потім в одну з пробірок додати 2-3 краплі розчину хлоридної кислоти, а в другу – стільки ж крапель 30% розчину натрій гідроксиду до повного розчинення утворених осадів. Написати рівняння реакцій. Зробити висновок про властивості алюміній гідроксиду. Розчин гексагідроксоалюмінату натрію залишити для досліду 7б.
Дослід 7. Гідроліз солей алюмінію
а). На смужку універсального індикаторного паперу нанести 1-2 краплі розчину алюміній сульфату. За допомогою еталонної шкали визначити рН середовища. Написати йонне та молекулярне рівняння реакції гідролізу, враховуючи, що гідроліз перебігає тільки за першим ступенем.
б). До лужного розчину гексагідроксоалюмінат натрію одержаного в досліді 6 додати 5-6 крапель дистильованої води та декілька кристалів амоній хлориду. Прокип’ятити розчин до зникнення запаху амоніаку. Відмітити утворення осаду алюміній гідроксиду. Написати йонне та молекулярне рівняння гідролізу.
Дослід 8. Адсорбційні властивості алюміній гідроксиду
Одержати осад алюміній гідроксиду та відфільтрувати його. Промити осад на фільтрі. Пропустити через фільтр з осадом слабкозабарвлений розчин. Спостерігати зміну забарвлення фільтрату. На які властивості алюміній гідроксиду вказує цей дослід?
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1382; Нарушение авторских прав?; Мы поможем в написании вашей работы!