
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамические параметры состояния системы
|
|
|
|
Основные понятия и определения термодинамики
Термодинамика- это наука о взаимном преобразовании различных видов энергии (наиболее часто встречающиеся в природе тепловая и механическая виды энергии).
Объектом изучения термодинамики являются различные термодинамические системы.
Термодинамическая система представляет собой тело (несколько тел), способное обмениваться с другими телами (между собой) энергией и веществом.
То, что находится вне системы называется окружающей средой.
Например, термодинамическая система- это газ, находящейся в цилиндре с поршнем, а окружающая среда- это цилиндр, поршень, воздух, стены помещения.
Различают гомогенные (однородные) и гетерогенные (разнородные) термодинамические системы.
Гомогенная система - это система, внутри которой нет поверхностей раздела (например, вода, газы).
Гетерогенная система - это система, состоящая из нескольких гомогенных частей (фаз) с различными физическими свойствами, отделенных одна от другой видимыми поверхностями раздела (например, вода и пар).
Вещества обычно пребывают в одном из трёх основных состояний: в твердом, жидком или газообразном состоянии. Очевидно, что одно и то же вещество при разных условиях может находиться в различных состояниях и соответственно свойства вещества будут различными.
Свойства термодинамической системы могут быть интенсивными и экстенсивными.
Интенсивными называют свойства, не зависящие от количества вещества в системе (например, давление и температура).
Свойства, зависящие от количества вещества, называют экстенсивными. Примером экстенсивных свойств является объем, который изменяется пропорционально количеству вещества. Объем 10кг вещества при одних и тех же условиях будет в 10 раз больше, чем объем 1кг вещества.
Экстенсивные свойства термодинамической системы, отнесенные к массе вещества или другими словами удельные экстенсивные свойства приобретают смысл интенсивных. Так, удельный объем, удельная теплоёмкость и т.п. рассматриваются в качестве интенсивных свойств.
Интенсивные свойства, определяющие состояние термодинамической системы, называются термодинамическими параметрами состояния системы.
Наиболее удобными и поэтому наиболее распространенными параметрами состояния являются абсолютная температура, абсолютное давление и удельный объем (плотность) системы.
Температурой называется физическая величина, характеризующая степень нагретости тела. Понятие о температуре вытекает из следующего утверждения: если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениваться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
В качестве термодинамического параметра состояния системы принимают абсолютнуютемпературу Т. Она всегда положительна.
В системе СИ единицей температуры является кельвин (К); на практике широко применяется градус Цельсия (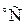 ). Соотношение между абсолютной Т и стоградусной t температурами имеет вид:
). Соотношение между абсолютной Т и стоградусной t температурами имеет вид:
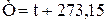
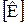
Давление с точки зрения молекулярно-кинетической теории есть сила ударов молекул газа, находящихся в непрерывном хаотическом движении, о единицу площади стенки сосуда, в котором заключен газ, т.е.:
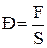
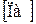
В системе СИ давление выражается в Паскалях. 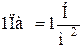 .
.
Различают избыточное и абсолютное давление.
Избыточное давление (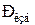 )- это разность между давлением жидкости или газа в сосуде и давлением окружающей среды. Привести пример!!!
)- это разность между давлением жидкости или газа в сосуде и давлением окружающей среды. Привести пример!!!
Абсолютное давление (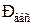 )- это давление, которое отсчитывается от абсолютного нуля давления или другими словами от абсолютного вакуума.
)- это давление, которое отсчитывается от абсолютного нуля давления или другими словами от абсолютного вакуума.
Именно абсолютное давление является термодинамическим параметром состояния системы.
Абсолютное давление определяется:
1). При давлении сосуда больше атмосферного:
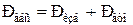
2). При давлении сосуда меньше атмосферного:
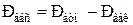
где 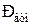 - атмосферное давление;
- атмосферное давление; 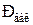 - давление вакуума (давление разрежения).
- давление вакуума (давление разрежения).
Удельный объем – это величина, которая определяется как отношение объема вещества к его массе:
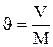
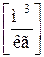
Между удельным объемом вещества и его плотностью существует очевидное соотношение:
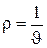
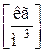
При отсутствии внешних воздействий на термодинамическую систему (например, со стороны гравитационного или электромагнитного поля) состояние системы считается определенным, т.е. известным если заданы 2 интенсивных параметра состояния системы.
Если, например, рассматривается водяной пар при температуре 2500С и атмосферном давлении, то удельный объем такого пара может иметь только одно значение 0,23м3/кг.
Таким образом, удельный объем данного вещества однозначно определяется давлением Р и температурой Т.
Если в различных точках термодинамической системы существуют различные значения температур, давлений и других параметров, то такая система является неравновесной.
Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным.
В классической термодинамике (т.е. термодинамике идеального газа) рассматриваются только равновесные системы.
В простейших равновесных термодинамических системах, которыми являются газы или пары, параметры состояния, т.е. удельный объем, температура и давление связаны уравнением состояния идеального газа:
- для М кг газа:
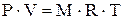
- для 1кг газа:
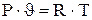
где 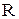 - газовая постоянная, которая определяется по формуле:
- газовая постоянная, которая определяется по формуле:
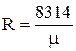
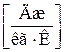
где 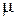 - молекулярная масса газа,
- молекулярная масса газа, 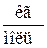 .
.
Изменение состояния термодинамической системы во времени называется термодинамическим процессом. Так, при перемещении поршня в цилиндре объем, а с ним давление и температура находящегося внутри газа будут изменяться, поскольку будет совершаться процесс расширения или сжатия газа.
Если в термодинамическом процессе изменение параметра состояния не зависит от вида процесса, а определяется начальным и конечным состоянием, то параметры состояния называются функцией состояния. Такими параметрами являются, например, внутренняя энергия и энтальпия системы.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 6886; Нарушение авторских прав?; Мы поможем в написании вашей работы!