
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Под химическим воздействием факторов окружающей среды подразумевается влияние на металлические и неметаллические материалы различных газов
|
|
|
|
Под химическим воздействием факторов окружающей среды подразумевается влияние на металлические и неметаллические материалы различных газов, жидкостей, излучений. В зависимости от видов материала и воздействующих факторов различают коррозию металлов, радиационное старение материалов, растворение неметаллических материалов.
К о р р о з и е йметаллов называется самопроизвольное разрушение металлических материалов вследствие химического или электрохимического взаимодействия с окружающей средой. Это объясняется стремлением металла при контакте с наиболее распространенной окислительной средой перейти в термодинамически более устойчивое, химически связанное (окисленное) состояние с измененными свойствами поверхности.
Принципиальная возможность или невозможность самопроизвольного протекания какого-либо процесса, включая коррозионный, в данной системе определяется знаком отклонения ее термодинамического потенциала от равновесного состояния. Критерием равновесия либо самопроизвольного протекания процесса служит изобарно-изотермический потенциал.
Он представляет характеристическую функцию состояния системы, уменьшение которой в обратимом процессе при постоянных давлении и температуре равно максимальной полезной работе.
Установлено, что любой самопроизвольный изобарно-изотермический процесс сопровождается уменьшением потенциала системы на величину 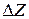 . Таким образом, если при данных условиях величина
. Таким образом, если при данных условиях величина 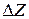 < 0, т.е. потенциал корродирующей системы убывает, то процесс коррозии является возможным; если значение
< 0, т.е. потенциал корродирующей системы убывает, то процесс коррозии является возможным; если значение 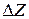 > 0, т.е. потенциал системы возрастает, то процесс коррозии невозможен; в случае, когда
> 0, т.е. потенциал системы возрастает, то процесс коррозии невозможен; в случае, когда 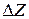 = 0, т.е. потенциал системы не изменяется, то система находится в равновесии.
= 0, т.е. потенциал системы не изменяется, то система находится в равновесии.
Коррозионный процесс является гетерогенным, поскольку развивается на границе двух фаз: металлической и окружающей газообразной либо жидкой среды. Коррозия происходит с осуществлением трех основных стадий:
1) перенос реагирующих веществ к поверхности раздела фаз;
2) протекание гетерогенных реакций окисления металла с образованием свободных электронов и восстановление окислителя, присоединяющего электроны,
3) отвод продуктов реакции из реакционной зоны.
По механизму протекания различают химическую и электрохимическую коррозию.
Химическая коррозия развивается за счет совместного осуществления химической реакции окисления металла и восстановления окислителя среды в одном общем процессе на корродирующей поверхности металла. Такой вид коррозионного воздействия оказывают на металлы сухие газы, часто при высоких температурах (газовая коррозия). Реже встречается химическая коррозия в жидких неэлектролитах: жидкий бром, расплавленная сера, органические растворители, нефтепродукты. Продуктами газовой коррозии обычно являются металлооксидные пленки различной плотности.
В процессе химической коррозии окислитель, отнимая у металла валентные электроны, одновременно вступает с ним в химическое соединение, являющееся продуктом коррозии. При значениях p и T = const такое взаимодействие соответствует реакции:
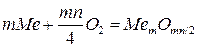 ,
,
где m – число атомов металла в молекуле оксида,
n – валентность металла.
Термодинамическая возможность химической коррозии, связанная с изменением потенциала 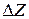 такой системы, определяется из данных химического равновесия по уравнению изотермы процесса окисления металла кислородом:
такой системы, определяется из данных химического равновесия по уравнению изотермы процесса окисления металла кислородом:
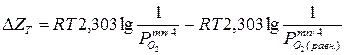 ,
,
где 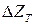 - изменение изобарно-изотермического потенциала системы,
- изменение изобарно-изотермического потенциала системы,
R = 8,31 дж/моль · k – газовая постоянная,
Т – абсолютная температура,
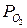 - парциальное давление кислорода, соответствующее исходному состоянию системы,
- парциальное давление кислорода, соответствующее исходному состоянию системы,
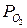 (равн.) – парциальное давление кислорода, соответствующее равновесному состоянию системы (давление диссоциации оксида, зависящее от температуры).
(равн.) – парциальное давление кислорода, соответствующее равновесному состоянию системы (давление диссоциации оксида, зависящее от температуры).
Из вышеприведенного уравнения следует, что 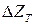 < 0 и реакция возможна, если
< 0 и реакция возможна, если 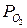 >
> 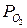 (равн.). При этом величина
(равн.). При этом величина 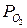 (равн.) зависит от температуры согласно выражению:
(равн.) зависит от температуры согласно выражению:
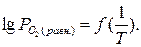
Если учесть, что при невысоких температурах на воздухе 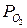 = 21 кПа, то для всех металлов, кроме Au,
= 21 кПа, то для всех металлов, кроме Au, 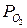 (равн.) < 21 кПа, из-за чего они окисляются.
(равн.) < 21 кПа, из-за чего они окисляются.
С повышением температуры величина 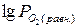 возрастает и термодинамическая возможность самопроизвольного окисления уменьшается. Однако устойчивость против окисления достигается только у Ag, Pt, Ir. Pd, Rh, Ru при тех температурах, где
возрастает и термодинамическая возможность самопроизвольного окисления уменьшается. Однако устойчивость против окисления достигается только у Ag, Pt, Ir. Pd, Rh, Ru при тех температурах, где 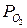 (равн.) > 21 кПа.
(равн.) > 21 кПа.
Газовая коррозия металлов имеет место во многих случаях действия различных аппаратов, оборудования, систем: при работе нагревательных устройств, реакторов химического синтеза, теплоэнергетических установок, в процессах изготовления деталей приборов и машин методами горячей обработки, а также в других отраслях производства и науки.
Поведение металлов в газах при высоких температурах характеризуют два основных свойства:
1) жаростойкость – способность материала сопротивляться коррозионному воздействию газов при высоких температурах,
2) жаропрочность – способность металла сохранять при высоких температурах необходимый уровень механических свойств, главным образом, длительной прочности и предела ползучести.
Часто бывает необходимо, чтобы металлоизделия обладали одновременно жаростойкостью и жаропрочностью, что является труднодостижимым. Например, многие сплавы алюминия на воздухе или в печных газах при температуре до 4500С являются достаточно жаростойкими, но не жаропрочными. Инструментальные быстрорежущие стали, содержащие вольфрам, при температурах до 7000С имеют хорошую жаропрочность, но не обладают жаростойкостью.
Большое влияние на жаростойкость металлов оказывают защитные свойства образующейся оксидной пленки, которые оцениваются по величине возникшей скорости окисления и по характеру изменения данной скорости во времени (рост толщины пленки). Уровень защитных свойств пленки во многом зависит от выполнения условия ее сплошности. Согласно данному условию молекулярный объем образующегося оксида Vок должен быть больше объема металла VМе, израсходованного на образование молекулы оксида, так что условие сполошности может быть выражено следующими отношениями:
если 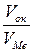 < 1, то пленка не может быть сплошной;
< 1, то пленка не может быть сплошной;
если 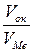 > 1, то пленка может быть сплошной.
> 1, то пленка может быть сплошной.
Величина отношения Vок и VМе может быть рассчитана по формуле:
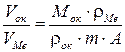 ,
,
где Мок – молекулярная масса оксида,
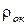 - плотность оксида,
- плотность оксида,
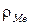 - плотность металла,
- плотность металла,
m – число атомов металла в молекуле оксида,
А – атомная масса металла.
Не удовлетворяют условию сплошности пленки на всех щелочных и щелочноземельных металлах (за исключением Be), на других металлах образуются сплошные оксидные пленки.
Однако выполнение рассмотренного условия сплошности является необходимым, но недостаточным условием формирования высоких защитных свойств пленки.
Если условие сплошности характеризуется отношением 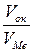
 >> 1, как, например, у оксидов Mo, W, то в пленке возникают внутренние напряжения, которые могут превысить предел ее прочности и вызвать растрескивание либо отслаивание с потерей защитных свойств. Было установлено, что для формирования высоких защитных свойств отношение объемов должно удовлетворять дополнительному условию:
>> 1, как, например, у оксидов Mo, W, то в пленке возникают внутренние напряжения, которые могут превысить предел ее прочности и вызвать растрескивание либо отслаивание с потерей защитных свойств. Было установлено, что для формирования высоких защитных свойств отношение объемов должно удовлетворять дополнительному условию:
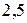 >
> 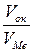 > 1.
> 1.
Данное условие применимо не только для оксидных пленок, но и к другим пленкам продуктов коррозии на металлах.
Жаростойкие сплавы делятся по уровню стойкости на группы, в кторых сплавы имеют жаростойкость очень высокую, большую, умеренную.
Очень жаростойкие сплавы образуют пленки, устойчивые вплоть до температуры плавления 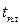 , к ним относятся, например, хромаль Х30Ю5, алюминий, сплавы кобальтохромомолибденовый, кобальтохромовольфрамовый.
, к ним относятся, например, хромаль Х30Ю5, алюминий, сплавы кобальтохромомолибденовый, кобальтохромовольфрамовый.
Большую жаростойкость имеют сплавы, устойчивые до температур 0,75 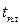 : хромоникелевая сталь Х14Н14В2М, бериллиевая бронза БрБ2,5, алюминиевая бронза БрА7.
: хромоникелевая сталь Х14Н14В2М, бериллиевая бронза БрБ2,5, алюминиевая бронза БрА7.
Умеренная жаростойкость характеризует сплавы, устойчивые против окисления до температур 0,5 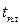 : сильхром Х9С2, алюминиевая латунь ЛА70-2.
: сильхром Х9С2, алюминиевая латунь ЛА70-2.
При очень высоких температурах и в весьма агрессивных средах применяются керамические материалы, но при высоких механических нагрузках, а также для изготовления слжных деталей металлические сплавы остаются незаменимыми.
Электрохимическая коррозия происходит благодаря протеканию электрохимических реакций окисления металла и восстановления окислителя в отдельных процессах, со скоростями, зависящими от электродного потенциала металла, при взаимодействии с электролитически проводящей средой. Этот вид коррозии развивается под воздействием на металл жидких электролитов: воды, водных растворов солей, кислот, щелочей, расплавленных кислот и щелочей. Продукты электрохимической коррозии представляют гидроксиды иногда – соли металлов.
Металл, обладающий электронной проводимостью, контактирует с электролитом, у которого имеется ионная проводимость, и в результате их электрохимического взаимодействия металл становится электродом. При этом возникает окисление металла путем перехода его ионов из узлов атомно-кристаллической решетки в раствор, а также восстановление ионов за счет их перехода из раствора на поврехность металла с включением в кристаллическую решетку и образованием атомов согласно обратимой реакции:
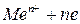
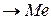 .
.
Динамическое равновесие такого ионного обмена создает в контактной зоне слой катионов и слой электронов – двойной электрический слой.
Если катионы в металле более активные, то их больше переходит в приповерхностную зону электролита с оставлением электронов в поверхностной зоне металла. Данный окислительный, или анодный процесс обеспечивает положительный потенциал металла, называемого анодом:
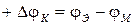 ,
,
где 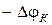 - катодный потенциал электрода, В.
- катодный потенциал электрода, В.
Равновесный (обратимый) потенциал металла 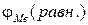 в электролите устанавливается, когда в ионном обмене участвует только ионы данного металла.
в электролите устанавливается, когда в ионном обмене участвует только ионы данного металла.
Стандартный потенциал металла 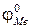 представляет его равновесный потенциал в стандартных условиях: при активности его ионов в растворе, равной 1, давлении 0,1 МПа, температуре +250С. Измерение стандартных потенциалов металлов с помощью стандартного водородного электрода сравнения, потенциал которого принят равным нулю Вольт, позволило составить ряд напряжений металлов, или ряд их электрохимической активности (табл.3).
представляет его равновесный потенциал в стандартных условиях: при активности его ионов в растворе, равной 1, давлении 0,1 МПа, температуре +250С. Измерение стандартных потенциалов металлов с помощью стандартного водородного электрода сравнения, потенциал которого принят равным нулю Вольт, позволило составить ряд напряжений металлов, или ряд их электрохимической активности (табл.3).
Таблица 3
Ряд электрохимической активности металлов
| Li | Al | Ti | Zr | Cr | Fe | Cd | Co | Ni | H | Cu | Ag | Pd | Ir | Pt | Au |
| -3,01 | -1,66 | -1,63 | -1,53 | -0,74 | -0,44 | -0,40 | -0,28 | -0,25 | +0,34 | +0,80 | +0,99 | +1,16 | +1,19 | +1,69 |
Металлы с более электроотрицательным потенциалом обладают повышенной способностью к переходу в ионное состояние, что увеличивает их электрохимическую активность, т.е. снижает коррозионную стойкость.
Неравновесный потенциал металла устанавливается, если в ионном обмене с электролитом участвуют не только ионы данного металла, но и другие ионы. Скорости реакций данного обмена различны, поэтому обмен является необратимым и создает неравновесный потенциал.
Стационарный потенциал металла 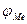 формируется при стабилизации во времени скоростей анодных и катодных процессов, а также величины неравновесного потенциала, который становится подобным равновесному. В этих условиях процесс анодного растворения осуществляется, в основном, благодаря переходу в электролит ионов металла, катодный процесс – за счет присоединения электронов на металле другими ионами либо молекулами электролита – деполяризаторами D.
формируется при стабилизации во времени скоростей анодных и катодных процессов, а также величины неравновесного потенциала, который становится подобным равновесному. В этих условиях процесс анодного растворения осуществляется, в основном, благодаря переходу в электролит ионов металла, катодный процесс – за счет присоединения электронов на металле другими ионами либо молекулами электролита – деполяризаторами D.
Таким образом, сущность электродных процессов коррозии металла при его стационарном потенциале в электролите включает два основных явления:
1) анодный (окислительный) процесс – образование гидратированных ионов металла в электролите и свободных электронов на поверхности металла:
Ме + m H2O = Men+ · m H2O + ne,
2) катодный (восстановительный) процесс – ассимиляция (присоединение) электронов какими-либо ионами (кроме ионов данного металла) или молекулами раствора – деполяризаторами D:
ne + D = [ Dne ].
Способность металла к анодному процессу, т.е. к отдаче своих ионов в раствор, количественно характеризуется величиной равновесного потенциала металла в данных условиях:
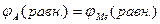 .
.
Способность данного деполяризатора к катодному процессу, т.е. к реакции присоединения электронов, количественно определяется значением равновесного потенциала данной реакции 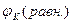 .
.
Все металлы приобретают стационарный потенциал в растворах, содержащих чужеродные ионы, таких, как H2O, NaCl, H2SO4 и др. Величина стационарного потенциала металла зависит как от внутренних атомов, связанных с самим металлом, так и от внешних факторов, характеризующих электролит и окружающие условия.
Термодинамическая возможность электрохимической коррозии металла, так же как и химическая коррозия определяется знаком изменения изобарно-изотермического потенциала 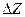 системы, который должен удовлетворять условию:
системы, который должен удовлетворять условию:
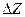 < 0.
< 0.
Для электрохимической коррозии данное условие выявляется по характеру величины эдс системы электрод – электролит из уравнения:
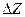 = – nEF
= – nEF
где 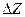 - изменение изобарно-изотермического потенциала системы,
- изменение изобарно-изотермического потенциала системы,
n – число грамм-эквивалентов раствора,
Е = 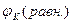 –
– 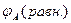 – эдс системы электрод-электролит,
– эдс системы электрод-электролит,
F = 96500 Кл – число Фарадея.
Данное уравнение показывает, что значение 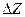 < 0 и электрохимическая коррозия термодинамически возможна, когда величина Е > 0. Для этого необходимо соотношение
< 0 и электрохимическая коррозия термодинамически возможна, когда величина Е > 0. Для этого необходимо соотношение 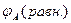 <
< 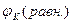 , которое обусловливается присутствием в электролите вещества-деполяризатора, имеющего величину равновесного потенциала окислительно-восстановительного процесса более электроположительную, чем равновесный потенциал металла в данных условиях.
, которое обусловливается присутствием в электролите вещества-деполяризатора, имеющего величину равновесного потенциала окислительно-восстановительного процесса более электроположительную, чем равновесный потенциал металла в данных условиях.
При реальном взаимодействии металлоизделий с электролитами на поверхности металла присутствуют макро- и микроучастки, различающиеся по химсоставу, структурно-фазовому состоянию, морфологии, физико-механическим свойствам. Это придает данным участкам отличия по величине электродных потенциалов, т.е. обусловливает электрохимическую гетерогенность поверхности, создавая на ней участки анодные – с более отрицательным потенциалом и катодные – с более положительным потенциалом.
Анодные и катодные реакции локализуются на этих участках, где их протекание наиболее облегчено и является пространственно разделенным. Поэтому электрохимическая коррозия поверхности происходит с перемещением электронов в металле и ионов в электролите при возникновении коррозионного тока подобно работе короткозамкнутого гальванического элемента.
Таким образом, электрохимическая коррозия является результатом работы большого числа коррозионных гальванических элементов на электрохимически гетерогенной поверхности металла, контактирующей с электролитом. В первом приближении эту поверхность можно рассматривать как двухэлектродную (бинарную) систему, состоящую из участков двух видов: анодных с более отрицательным электродным потенциалом 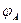 и катодных с более положительным потенциалом
и катодных с более положительным потенциалом 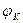 , чем создается разность потенциалов.
, чем создается разность потенциалов.
Электрохимическое коррозионное растворение металлов включает три основных, одновременно протекающих, процесса:
1) анодный – образование гидратированных ионов металла в электролите и избыточных электронов на анодных участках металла с коррозионной потерей массы,
2) перетекание электронов по металлу от анодных участков к катодным и соответствующее перемещение ионов в электролите,
3) катодный – ассимиляция электронов на катодных участках.
Перетекание электронов от анода к катоду могло бы сравнять их потенциалы, т.е. вызвать полную поляризацию электродов и прекращение коррозии. В действительности за счет протекания электродных процессов поддерживается разность потенциалов, т.е. происходит деполяризация электродов. Главную роль при этом играют деполяризаторы – молекулы или ионы электролита, способные на катоде ассимилировать электроны, образовавшиеся на аноде. Это обусловлено более положительным равновесным потенциалом окислительно-восстановительных реакций деполяризатора по сравнению с равновесным потенциалом металла.
Наибольшее значение в реальных условиях электрохимической коррозии имеют катодные реакции кислородной деполяризации:
O2 + 4e + 2H2O = 4OH-,
И водородной деполяризации:
H+ · H2O + e = ½ H2 + H2O.
С кислородной деполяризацией корродируют металлы, находящиеся в атмосфере, в грунте, соприкасающиеся с водой, с водными растворами нейтральных солей, так что коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом.
Равновесный потенциал кислородного электрода на воздухе в нейтральном электролите составляет 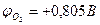 . При изменениях парциального давления кислорода и величины рН раствора равновесный потенциал кислородного электрода
. При изменениях парциального давления кислорода и величины рН раствора равновесный потенциал кислородного электрода 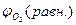 приобретает другие, но также сильно положительные значения. Поэтому условие термодинамической возможности коррозии с кислородной деполяризацией
приобретает другие, но также сильно положительные значения. Поэтому условие термодинамической возможности коррозии с кислородной деполяризацией 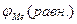 <
< 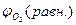 выполняется для многих металлов и видов коррозионных сред.
выполняется для многих металлов и видов коррозионных сред.
С водородной деполяризацией корродируют металлы, контактирующие с растворами кислот, что происходит в отдельных видах производств и чем обусловлена малая распространенность коррозии с водородной деполяризацией.
Равновесный потенциал водородного электрода на воздухе в кислом электролите при рН = 0 составляет 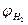 = +0,186 В, т.е. слабо положительную величину. При всех других значениях рН и изменениях парциального давления водорода равновесный потенциал водородного электрода принимает отрицательные значения. Поэтому коррозия металлов с водородной деполяризацией является термодинамически менее вероятным процессом, чем с кислородной деполяризацией.
= +0,186 В, т.е. слабо положительную величину. При всех других значениях рН и изменениях парциального давления водорода равновесный потенциал водородного электрода принимает отрицательные значения. Поэтому коррозия металлов с водородной деполяризацией является термодинамически менее вероятным процессом, чем с кислородной деполяризацией.
В условиях повышенной интенсивности окисления при электрохимической коррозии на поверхности многих металлов могут возникать первичные фазовые или адсорбированные пленки с защитными свойствами. Их присутствие сильно затормаживает анодные процессы ионизации атомов металла и диффузии ионов со значительным смещением потенциала металла в положительную сторону. В результате резко снижаются скорость анодного растворения металла и характеризующий ее коррозионный ток, что представляет пассивность металла.
В определенных случаях электрохимической коррозии пассивность наступает у Ti, Al, Cr, Mg, Ni, Co, Fe, многие другие металлы при этом проявляют склонность к пассивации.
Практические условия электрохимической коррозии металлоизделий и конструкций обусловливают незначительное омическое сопротивление анодных и катодных процессов. Вследствие этого разность их равновесных потенциалов расходуется на преодоление поляризационных сопротивлений, кроме условий очень низкой электропроводности электролита или коррозии под его очень тонкой пленкой. Поэтому на корродирующей поверхности металла устанавливается общий стационарный потенциал 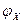 , который зависит от величины стандартного потенциала металла
, который зависит от величины стандартного потенциала металла 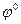 . В качестве основного внутреннего фактора коррозии стандартный потенциал
. В качестве основного внутреннего фактора коррозии стандартный потенциал 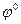 характеризует термодинамическую устойчивость металла в различных средах.
характеризует термодинамическую устойчивость металла в различных средах.
Из внешних факторов коррозии наибольшее влияние на коррозионную стойкость металлов оказывает величина рН среды, что позволяет разделить металлы на несколько основных групп.
Высокую коррозионную стойкость в большинстве видов окружающей среды независимо от ее рН проявляют Au, Pt, Ag благодаря большим положительным значением их стандартных потенциалов.
Малостойкими в кислых растворах, недостаточно стойкими в нейтральных растворах и стойкими в щелочных растворах являются Mg, Mn, Fe, что обусловлено свойствами их защитных гидроксидных пленок, растворимыми в кислотах и малорастворимыми в щелочных растворах.
Неустойчивостью в кислых растворах и стойкостью в щелочных растворах характеризуются Ni, Co, Cd благодаря высоким защитным свойствам их оксидных и гидроксидных пленок.
Коррозионностойкими в кислых, но малостойкими в щелочных растворах являются Ta, Mo, W, что связано с кислотным характером защитных пленок их оксидов.
Коррозионную стойкость в нейтральных электролитах, но неустойчивость в кислых и щелочных растворах проявляют Zn, Al, Sn, Pb, Bi, Be, Cu вследствие растворимости их оксидных и гидроксидных пленок в кислотах и щелочах.
Уровень коррозионной стойкости металлов определяется путем коррозионных испытаний, которые проводятся по различным методам в соответствии с разнообразием реальных условий коррозии и включают три основных группы:
1) лабораторные коррозионные исследования образцов в созданных лабораторных условиях,
2) внелабораторные коррозионные испытания образцов в реальных эксплуатационных условиях,
3) эксплуатационные коррозионные испытания приборов, механизмов, машин в реальных условиях.
Показатели коррозионной стойкости металлов разделяются на два вида.
1. Качественные показатели: характеристика коррозионных признаков внешнего вида, микроструктуры металла, цвета специальных индикаторов на поверхности.
2. Количественные показатели: время до появления первого коррозионного центра, число коррозионных центров, возникших в единицу времени, глубина коррозионных разрушений, изменение массы образца, объем газа, выделившегося или поглощенного образцом металла в единицу времени, плотность коррозионного тока, относительные изменения механических свойств, электрического сопротивления, отражательной способности.
Показатель коррозии выбирается в зависимости от метода коррозионных испытаний. Наиболее распространенным и рекомендованным стандартом является глубинный показатель коррозии:
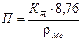 ,
,
где П – глубинный показатель проникновения коррозии, мм/год,
К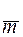 – показатель убыли массы при равномерной коррозии металла, г/м3·ч,
– показатель убыли массы при равномерной коррозии металла, г/м3·ч,
ρМе – плотность металла, г/см3.
С использованием глубинного показателя коррозии разработана десятибалльная шкала коррозионной стойкости металлов в данной среде. Согласно этому, если, например, в растворах кислот глубинный показатель для коррозионностойких сталей составляет от 0,005 до 0,1 мм/год, то это соответствует группе “стойкие” с баллами 4 и 5. Благородные металлы Ag, Au, Pt, Pd, а также Ti и его сплавы имеют наибольшую коррозионную стойкость в таких средах, они относятся к группам “совершенно стойкие” и “весьма стойкие” с баллами 1, 2, 3. Коррозионная стойкость других цветных металлов и сплавов соответствует группам “стойкие”, “пониженно-стойкие” с баллами 4, 5, 6, 7.
Р а д и а ц и о н н о е с т а р е н и е металлов и неметаллов происходит под влиянием корпускулярных или волновых радиоактивных излучений высокой энергии. При этом возникают изменения физических, механических, коррозионных свойств, растворимости материалов.
Корпускулярные излучения представляют быстрые и медленные нейтроны, ядра и осколки ядер, α - частицы и β - лучи.
Волновые излучения включают γ - лучи, жесткое и мягкое рентгеновские излучения.
Интенсивность излучения оценивается в рентгенах (р), нейтронный поток измеряется суммарным числом нейтронов, прошедших через площадь 1 м2.
Облучение материалов вызывает смещение атомов в междоузлия и образование вакансий, число этих дефектов возрастает с ростом суммарного числа нейтронов. Низкотемпературное облучение создает упрочнение металлов с повышением хрупкости. При повышенных температурах и больших потоках образуются скопления дислокаций, что приводит к возникновению микропор и “распуханию” металла: изменению формы и размеров детали с ухудшением механических свойств.
Коррозионная стойкость металлов при облучении снижается за счет разрушения поверхностных защитных пленок, а также уменьшения электрохимического потенциала и роста активности металла из-за структурных микроповреждений. Наибольшее влияние облучение оказывает на поверхностные свойства материала, по мере удаления от поверхности энергия излучения поглощается согласно закону:
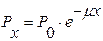 ,
,
где Р х – мощность физической дозы излучения на глубине х, р/с,
Р 0 – мощность физической дозы у поверхности материала, р/с,
μ – эффективный коэффициент ослабления излучения в материале, зависящий от природы материала и качества излучения.
Наибольшие объемные изменения вызывает облучение потоком быстрых нейтронов. Существует пороговая плотность потока нейтронов, ниже которого влияние облучения на материалы является незначительным. Главную роль в сопротивлении радиационному старению играет вид межатомной связи материала, среди которых наибольшую стойкость проявляет металлическая связь, наименьшую стойкость – молекулярная связь.
Высокие значения пороговой плотности составляют F =1024–1026 нейтронов/м2 для углеродистых, легированных аустенитных сталей, керамики, сплавов алюминия, циркония, никеля.
Органические полимерные материалы имеют более низкую радиационную стойкость. Они значительно уменьшают свои механические свойства при облучении, у многих из них происходит газовыделение, изменение диэлектрических свойств даже при воздействии менее сильных, чем нейтронное, излучений. Наименьшую пороговую плотность F =1019 нейтронов/м2 имеет полиметилметакрилат, еще ниже пороговая плотность F =1018 нейтронов/м2 у полупроводниковых германиевых и кремниевых материалов.
Р а с т в о р е н и е неметаллических твердых материалов происходит при их контактировании с нейтральными либо дипольными жидкостями. Растворимость материала оценивается его количеством, перешедшим в раствор в единицу времени, иногда растворимость характеризуется наибольшим количеством материала, которое может быть растворено в данном растворителе.
Сильнее всего растворяются материалы, близкие к растворителю по химической природе и содержащие в молекулах сходные группировки атомов; нейтральные вещества лучше растворяются в нейтральных жидкостях, дипольные вещества – в дипольных жидкостях. Например, неполярные либо слабополярные органические полимеры (каучук, парафин) легче растворяются в жидких углеводородах, дипольные смолы с гидроксильными группами (феноло-формальдегиды) растворяются в спирте и других полярных растворителях. С повышением степени полимеризации (ростом молекулярной массы) растворимость уменьшается; линейная структура высокомолекулярных полимеров облегчает растворение, при наличии пространственной структуры растворимость полимеров сильно затрудняется или вовсе отсутствует.
С повышением температуры растворимость материалов, обычно, увеличивается.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 798; Нарушение авторских прав?; Мы поможем в написании вашей работы!