
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диаграммы состояния сплавов
|
|
|
|
В зависимости от взаимной растворимости компонентов, результатов их физико-химического взаимодействия диаграммы состояния сплавов могут иметь несколько основных видов.
Диаграмма состояния сплавов с неогра-ниченной растворимостью компонентов уста-навливает температуры, при которых происходят начало и окончание превращений имеющихся двух фаз сплава – жидкой и твердой (рис. 17).
Точка А' соответствует равновесной температуре кристаллизации либо плавления компонента А, точка В' – равновесной температуре тех же превращений компонента В. Линия А'mB' характеризует изменение температуры начала кристаллизации жидких сплавов в зависимости от концентрации компонентов и называется «ликвидус», что по-латыни означает «жидкий». Линия А'nВ' указывает на изменение температуры окончания кристаллизации сплавов в зависимости от их концентрации и называется «солидус» (по-латыни «твердый»).
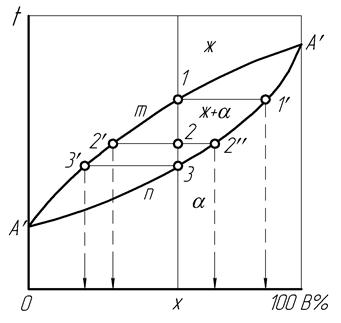
Рис. 17. Диаграмма состояния сплавов с неограниченной растворимостью компонентов
Таким образом, на диаграмме имеются три области: ж – жидкий сплав (выше ликвидуса), (ж + a) – жидкий сплав и кристаллы a - твердого раствора (между ликвидусом и солидусом), a - твердый раствор (ниже солидуса).
Анализ диаграммы состояния позволяет для сплава любой концентрации и при любой температуре определить его фазовое состояние, состав фаз и количественное соотношение между фазами. Для этого через точку концентрации сплава, например, Х проводится вертикаль и рассматриваются превращения сплава в трех названных областях диаграммы при охлаждении.
В жидкофазной области сплав обладает бивариантным равновесием (С =2), которое сохраняется при изменениях концентрации и температуры.
Во время достижения температурой жидкого сплава точки 1 на ликвидусе начинает выделяться вторая фаза – кристаллы твердого раствора, и равновесие становится моновариантным (С =1). Из-за этого дальнейшее охлаждение и поддержание равновесного фазового состояния происходит только при соответствующих изменениях концентрации жидкой и твердой фаз. Эти равновесные концентрации при каждой определенной температуре характеризуются соответствующими точками на ликвидусе и солидусе, связанными прямой, параллельной оси концентраций и называемой «конодой». Для данной температуры начала кристаллизации в точке 1 конодой является прямая 1– 1'. Перпендикуляры, опущенные из ее концов на ось концентраций, показывают, что в начале кристаллизации жидкая фаза имеет исходную концентрацию Х, а выделяющиеся кристаллы обогащены более тугоплавким компонентом В.
При дальнейшей кристаллизации с охлаждением сплава до температуры точки 2 происходит изменение концентрации как жидкой фазы за счет ее обогащения компонентом А по ликвидусу от точки 1 к точке 2', так и кристаллов твердой фазы по солидусу от точки 1' к точке 2'' путем диффузии в них компонента А из жидкости. Рассмотренные процессы подчиняются правилу концентраций, согласно которому для определения концентрации двух фаз сплава через точку его двухфазного состояния на диаграмме проводится конода, после чего проекция точки ее пересечения с ликвидусом на горизонтальную ось диаграммы указывает концентрацию жидкой фазы, а проекция точки пересечения коноды с солидусом – концентрацию твердой фазы.
Ко времени снижения температуры до точки 3 солидуса заканчивается кристаллизация жидкости, получившей обогащение компонентом А по ликвидусу от точки 2' к точке 3'. В это же время благодаря диффузии происходит повышение содержания компонента А в кристаллах по солидусу от точки 2'' к точке 3, где окончательно затвердевший сплав приобретает исходную концентрацию Х, и его равновесие становится бивариантным (С =2).
По результатам анализа диаграммы можно построить кривую охлаждения сплава любой концентрации с указаниями о фазовых состояниях и фазовых превращениях во всех областях диаграммы (рис. 18). При этом записывается схема фазового превращения жидкости в кристаллы с характеристиками температурного интервала превращения (вверху) и изменений концентрации фаз (внизу):
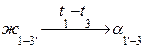
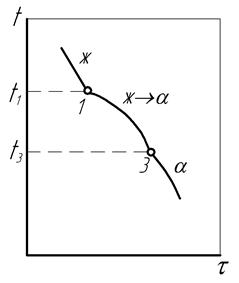
Рис. 18. Кривая кристаллизации сплава с неограниченной растворимостью компонентов и концентрацией Х
В случае ускоренного охлаждения сплава процесс диффузионного выравнивания химического состава кристаллов твердого раствора отстает от скорости кристаллизации, из-за чего возникает химическая неоднородность затвердевшего сплава, называемая ликвацией. Каждый кристалл при этом получает обогащение своей внутренней части более тугоплавким компонентом В, что представляет внутрикристаллитную (дендритную) ликвацию. В объеме металлической отливки такое обогащение наблюдается у ее поверхностных кристаллических слоев, что называется зональной ликвацией. В большинстве случаев из-за ликвации возникает неоднородность свойств литого изделия и происходит ухудшение его качества.
С использованием диаграммы возможно определение количественного отношения объемов фаз в двухфазной области сплава, что производится при помощи правила отрезков. Оно определяет, что объемы жидкой фазы Vж и твердой фазы Va обратно пропорциональны длинам отрезка коноды 2 – 2', прилегающего к ликвидусу, и отрезка 2 – 2'', прилегающего к солидусу (рис. 17):
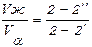 .
.
По диаграмме рассмотренного типа кристаллизуются такие сплавы, как
Cu – Ni, Fe – Ni, Co – Ni, Sb – Bi и др.
Диаграмма состояния сплавов с растворимостью компонентов в жидком состоянии, с нерастворимостью и образованием эвтектики в твердом характеризует температуры превращений трех фаз: жидкой, кристаллов А и В (рис. 19).
Линии ликвидус A'DB' и солидус CDE формируют на диаграмме три фазовых области. Выше ликвидуса существует жидкий сплав, который при охлаждении ниже участка A'D выделяет кристаллы А, ниже участка DB' – кристаллы В. При температуре ниже солидуса CDE затвердевший сплав состоит из кристаллов А и В.
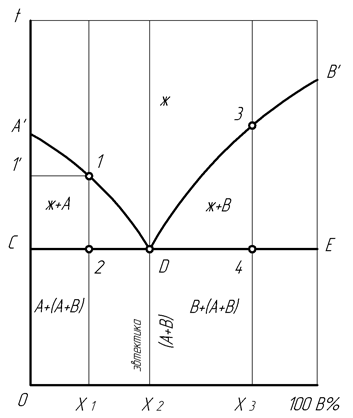
Рис. 19. Диаграмма состояния сплавов с нерастворимостью компонентов
Для сплавов с концентрацией Х1 (менее Х2) в точке 1 ликвидуса начинается выделение кристаллов А, обусловливая моновариантное равновесие (С =1). Согласно правилу концентраций, понижение температуры до точки 2 солидуса, не меняя состава кристаллов А на участке 1/ – С приводит к обогащению жидкости компонентом В по ликвидусу от точки 1 до то точки D. Здесь жидкость приобретает концентрацию Х2 так, что в точке 2 жидкость завершает кристаллизацию при наиболее низкой температуре с одновременным выделением кристаллов А и В. Температура этого превращения остается постоянной, поскольку фазовое равновесие становится нонвариантным (С =0).
Такой сплав является эвтектикой (легкоплавящимся), процесс его кристаллизации из жидкого состояния с образованием двух твердых фаз представляет эвтектическое превращение. Правило отрезков показывает, что после затвердевания сплава Х1 доля выделившихся в нем кристаллов А пропорциональна отрезку 2 – D, доля эвтектики, содержащей кристаллы А и В, пропорциональна отрезку С – 2. Структура эвтектики характеризуется кристаллическими зернами в виде дендритных сростков фазовых частиц различной формы. Эти фазы находятся в сложной физико-химической взаимосвязи, что придает эвтектике свойства отличные от свойств каждой фазы. Затвердевшая эвтектика имеет концентрацию Х2 и, являясь двухфазной структурой, сохраняет при окончательном охлаждении моновариантное равновесие (С =1).
Концентрация сплава Х2 является эвтектической, такой сплав сохраняет жидкое состояние до наиболее низкой, эвтектической температуры. При ее достижении из жидкости происходит быстрое, эвтектическое выделение фазовых кристаллов А и В при сохранении постоянной температуры, т.к. превращение является нонвариантным (С =0).
Сплавы с концентрацией менее, чем Х2 называются доэвтектическими, при концентрации более Х2 сплавы относятся к заэвтектическим. Кристаллизация заэвтектических сплавов, например, Х3 характеризуется превращениями, подобными рассмотренному доэвтектическому сплаву Х1. Они происходят при температурах ниже точки 3 ликвидуса и отличаются выделением из жидкости кристаллов В с одновременным обогащением жидкости компонентом А. Во время достижения эвтектической температуры точки 4 солидуса сплав затвердевает с образованием структуры, содержащей кристаллы В и ту же эвтектику из кристаллов А и В.
Кривые охлаждения рассмотренных типов сплавов с нерастворимыми компонентами и схемы фазовых превращений характеризуют процессы, протекающие во всех областях диаграммы (рис. 20).
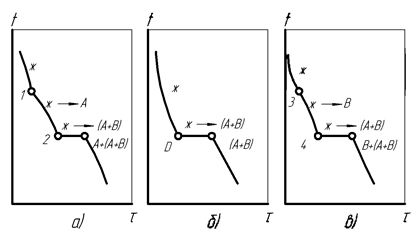
Рис. 20. Кривые кристаллизации сплавов с нерастворимыми компонентами
и образованием эвтектики: а - доэвтектический сплав концентрации Х1, б –эвтектический сплав концентрации Х2, в – заэвтектический сплав концентрации Х3
Рассмотренный тип диаграммы отражает кристаллизацию сплавов Pb – Sb, Pb – Ag, Sn – Zn, Bi – Cd и др.
Д и а г р а м м а с о с т о я н и я с п л а в о в с к о м п о н е н т а ми, о г р а н и ч е н н о р а с т в о р и м ы м и в ж и д к о м с о с т о я н и и и о б р а з у ю щ и м и э в т е к т и к у, учитывает имеющиеся пределы концентрации компонентов, до которых каждый из них может раствориться в другом (рис. 21). Поэтому кроме ликвидуса А'еВ' и солидуса А'aebB', на диаграмме имеются линии сольвус (раствор): ас – изменение растворимости В в А, bd – изменение растворимости А в В.
Существующий выше ликвидуса жидкий сплав при охлаждении ниже А'е выделяет кристаллы a с окончанием этой кристаллизации ниже участка А'а солидуса. При дальнейшем охлаждении устойчивость a- раствора сохраняется для сплавов с концентрацией от 0 до с. Во время охлаждения жидкости ниже участка еВ' происходит выделение кристаллов b, которое заканчивается ниже участка bB' солидуса, после чего b- раствор сохраняет свою устойчивость для сплавов с концентрацией от d до 100. Завершение кристаллизации сплавов с концентрацией от с до d происходит с образованием смеси кристаллов a- и b-растворов.
В сплавах с концентрацией от с до а', например, Х1 из жидкости в точке 1 образуются кристаллы a, тем самым создается моновариантное равновесие (С =1). С понижением температуры до точки 2 концентрация жидкости меняется по линии 1 – 2', концентрация кристаллов a – по линии 1'– 2. Последующее охлаждение кристаллов a происходит с бивариантным равновесием (С =2) до точки 3 сольвуса, где твердый раствор a оказывается насыщенным компонентом В. За счет этого компонент В выделяется с образованием кристаллов твердого раствора bII, где индекс указывает на его возникновение не из жидкости, а из твердого раствора, равновесие системы становится моновариантным (С =1). При окончательном затвердевании концентрация кристаллов a изменяется по сольвусу от точки 3 к с, кристаллов bII – по сольвусу от точки 3/ к d; в этом случае доля кристаллов a соответствует длине отрезка Х1d, доля кристаллов bII – длине отрезка сХ1.
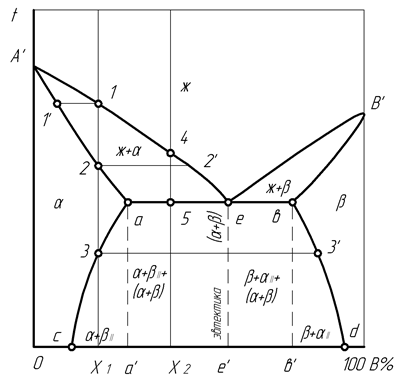
Рис. 21. Диаграмма состояния сплавов с компонентами, ограниченно растворимыми
и образующими эвтектику
Сплавы с доэвтектической концентрацией от а' до е', например, Х2 при охлаждении из жидкого состояния проявляют эвтектические свойства жидкости. Снижение температуры от точки 4 до точки 5 вызывает образование кристаллов a с повышением концентрации В до предельной растворимости в точке а и обогащение жидкости до эвтектической концентрации в точке е, что происходит при моновариантном равновесии (С =0) и постоянной температуре. Доля эвтектики в сплаве соответствует отрезку а5, кристаллы составляют долю, пропорциональную отрезку 5е.
При окончательном затвердевании сплава кристаллы a получают пересыщение компонентом В так, что из них выделяют кристаллы bII , фазовое равновесие становится моновариантным (С =1).
Эвтектический сплав концентрации е' сохраняет жидкое состояние до наиболее низкой температуры в точке е, где происходит его эвтектическое превращение с образованием эвтектики (a+b). Заэвтектические сплавы при охлаждении претерпевают превращения, подобные рассмотренному доэвтектическому сплаву Х2. В них из жидкости появляются кристаллы b - раствора, способные выделять вторичные кристаллы aII, в случае эвтектической концентрации жидкость образует эвтектику того же состава (a+b).
Кривые охлаждения характерных сплавов иллюстрируют рассмотренные превращения, соответствующие диаграмме состояния при ограниченной растворимости компонентов (рис. 22).
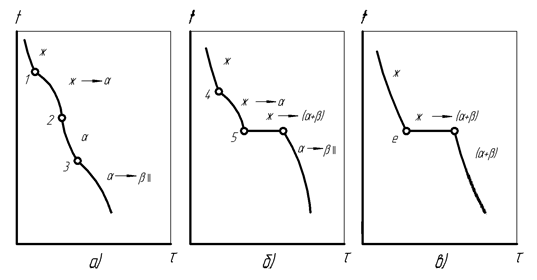
Рис.22. Кривые кристаллизации сплавов с ограниченной растворимостью компонентов: а – сплав доэвтектической концентрации Х1, б – сплав доэвтектической концентрации Х2, в – сплав эвтектической концентрации е'
Согласно приведенному типу диаграммы кристаллизуются сплавы Al – Cu, Al – Si, Cu – As, Cu – O и др.
Д и а г р а м м а с о с т о я н и я с п л а в о в с к о м п о н е н т а м и, р а с т в о р и м ы м и в ж и д к о м с о с т о я н и и и о б р а з у ю щ и м и у с т о й- ч и в о е х и м и ч е с к о е с о е д и н е н и е п р и к р и с т а л л и з а ц и ихарактеризуется однотипным эвтектическим взаимодействием между указанным химическим соединением и каждым компонентом сплава (рис. 22).
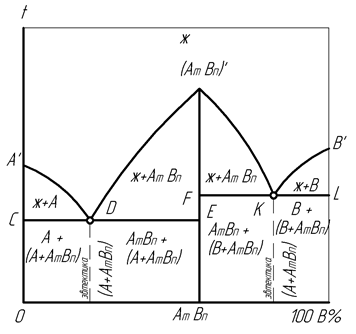
Рис. 23. Диаграмма состояния сплавов с компонентами, образующими устойчивое химическое соединение
Такие сплавы создаются между металлами и металлоидами при нормальной валентности, когда их химическое соединение вида АmBn приобретает температуру плавления более высокую, чем у компонентов А и В, поэтому представляет дистектику (трудноплавящееся). Это соединение не разлагается при нагреве до температуры плавления, на диаграмме играет роль самостоятельного компонента и создает максимум (AmBn)' на ликвидусе A'D (AmBn)' KB'.
При указанных условиях компонент AmBn как бы разделяет диаграмму на две части, левая из которых может рассматриваться как диаграмма состояния сплавов A – AmBn, правая – как диаграмма состояния сплавов AmBn – B.
Обе части диаграммы имеют характерные эвтектические концентрации сплавов, соответствующие точкам D и K, а также линии солидус CDE и FKL, определяющие значения постоянной температуры эвтектических превращений. Поэтому в процессе охлаждения жидкости все фазовые превращения происходят аналогично рассмотренной выше диаграмме состояния сплавов с нерастворимыми компонентами (рис. 19).
Согласно этой аналогии, после завершения кристаллизации ниже солидуса CDE сплавы содержат фазы A и AmBn при наличии эвтектической структуры (A+AmBn). Ниже солидуса FKL в сплавах имеются фазы B и AmBn, включая эвтектику (B+AmBn).
При наличии определенной растворимости между химическим соединением и компонентами сплава на данной диаграмме появляются области их полной или частичной растворимости, как было показано ранее на соответствующих диаграммах.
Рассмотренная диаграмма состояния характеризует превращения при кристаллизации сплавов Fe – O, Mn – S, Cu – P, Ca – Mg и др.
Анализ диаграмм состояния позволяет не только установить характеристики фазового состава и структурного состояния сплавов, но и предопределить свойства сплавов, зная свойства входящих в них компонентов. Взаимосвязь между диаграммами фазового равновесия сплавов и диаграммами изменения их основных свойств впервые была выявлена Н.С. Курнаковым, поэтому ее называют правилом Курнакова. При этом, если на диаграммах фазового равновесия по вертикальной оси откладываются температуры плавления и кристаллизации существующих фаз сплава, то на диаграммах Курнакова по вертикальной оси откладываются значения соответствующего свойства сплава при определенной температуре. Наиболее отчетливо указанные взаимосвязи проявляются при измерениях твердости НВ, пластичности d, электросопротивления r, коэрцитивной силы Нс, при оценке ферромагнитных свойств, коррозионной стойкости, обрабатываемости.
Правило Курнакова указывает, что при наличии в сплавах только одной фазы (твердого раствора) изменение ее состава вызывает криволинейную зависимость свойств, если же в сплавах присутствует двухфазная эвтектика, то зависимость свойств сплава является прямолинейной (рис. 24).
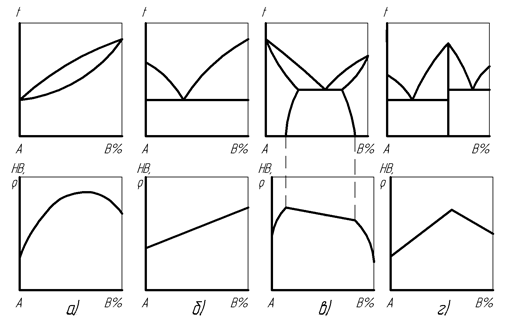
Рис. 24. Правило Курнакова для основных видов диаграмм состояния сплавов:
а – с образованием неограниченных твердых растворов, б – с образованием эвтектики, в – с образованием ограниченных твердых растворов,
г – с образованием химического соединения
При неограниченной растворимости компонентов образование уже небольшой концентрации фазы твердого раствора вызывает на диаграмме свойств резкое увеличение твердости НВ, электросопротивления r и других характеристик, превышающих соответствующие показатели свойств компонентов сплава (рис. 24, а). Такие сплавы отличаются хорошей обрабатываемостью давлением, невысокими показателями литейных свойств и обрабатываемости резанием.
В случае нерастворимости компонентов основные свойства двухфазной структуры с эвтектикой изменяются пропорционально соотношению фаз сплава и численно составляют средние арифметические значения свойств обеих фаз (рис. 24, б). У этих сплавов почти отсутствует обрабатываемость давлением, литейные свойства и обрабатываемость резанием являются повышенными.
Для ограниченной растворимости компонентов изменение свойств сплавов в однофазных областях соответствует криволинейным зависимостям, в двухфазной области – прямолинейной зависимости (рис. 24, в).
С образованием химического соединения свойства двухфазной структуры сплавов изменяются пропорционально соотношению фаз и достигают максимума при концентрации, отвечающей химическому соединению (рис. 24, г). Поэтому такие сплавы имеют значения твердости, хрупкости, температуры плавления значительно выше, чем исходные компоненты.
Правило Курнакова дает возможность производить рациональный выбор компонентов и концентрации сплава для получения фазового и структурного состояния, обусловливающего формирование заданных свойств сплава.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 4419; Нарушение авторских прав?; Мы поможем в написании вашей работы!