
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Плавление и кристаллизация металлов
Формирование кристаллической структуры металлов происходит в процессе их охлаждения из парообразного или расплавленного состояния. Это явление обусловлено действием второго закона термодинамики, согласно которому в макроскопических системах с изменением окружающих условий процессы развиваются в таком направлении, когда система приобретает более устойчивое состояние, с меньшим запасом свободной энергии.
При повышении окружающей температуры t жидкого либо твердого металла запас его свободной энергии G (энергии Гиббса) уменьшается, причем более резкое снижение наблюдается для жидкого состояния металла (рис.12,кривая 1). В точке, где обе кривые пересекаются, устанавливается равновесная температура tр, при которой одновременно существуют жидкая и твердая фазы металла, обладающие одинаковым запасом энергии Gp.
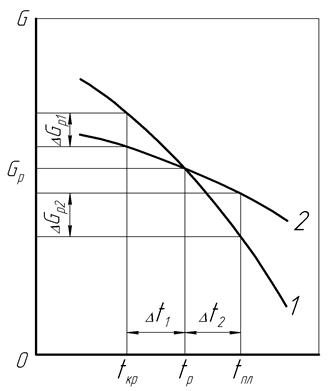
Рис. 12. Зависимость свободной энергии металла от изменения температуры в жидком и твердом состояниях: 1 – жидкий металл, 2 – твердый металл
Фазовый переход металла из жидкого в кристаллическое состояние может начаться при температуре tкр ., которая ниже равновесного значения tр на величину степени переохлаждения Dt1. Этим создается избыток свободной энергии DG1 жидкой фазы по сравнению с кристаллической фазой, что служит необходимым условием действия второго закона термодинамики и начала процесса кристаллизации.
С повышением температуры на величину степени перегрева Dt2 у твердой фазы металла возникает избыток свободной энергии DG2, и по вышеназванной причине начинается процесс плавления при температуре tпл.
Скорость процесса охлаждения, а также природа металла определяют величину степени переохлаждения, температуру и скорость кристаллизации, что иллюстрируют кривые охлаждения (рис. 13). Обычные небольшие скорости охлаждения V1 создают малые значения степени переохлаждения Dt1, за счет чего кристаллизация протекает почти при равновесной температуре tр в течение значительного времени t1–t2. Постоянная температура кристаллизации поддерживается благодаря саморегулируемой компенсации теплоотдачи в окружающую среду за счет соответствующего выделения внутренней теплоты кристаллизации, при этом величина Dt1 составляет 10...20°С.
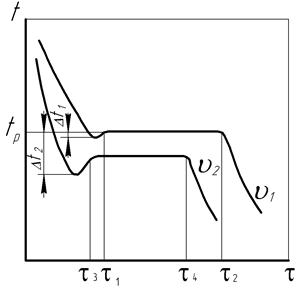
Рис. 13. Кривые кристаллизации металла при скоростях охлаждения V1<V2
При высоких скоростях охлаждения V2 степень переохлаждения увеличивается до значения Dt2 и может достигать нескольких сотен градусов. Продолжительность кристаллизации в этих условиях сокращается до величины t3–t4, температура кристаллизации становится ниже равновесного значения tр.
Д.К. Чернов установил, что скорость кристаллизации определяется двумя основными процессами: скоростью роста числа центров кристаллизации в единице объема и скоростью увеличения размеров кристаллических зерен.
Изменение этих параметров теоретически и экспериментально исследовал Г.Тамман, выявив при этом их зависимость от степени переохлаждения (рис. 14). Результаты исследования показали, что при нулевой величине степени переохлаждения Dt значения скорости роста числа центров кристаллизации в единице объема (Vчц, 1/мм3·с) и скорости увеличения размеров кристаллических зерен (Vск, мм/с) также равны нулю, и кристаллизация не идет. При малых значениях Dt быстрее нарастает скорость увеличения размеров кристаллов Vск (кривая 2), и зерна успевают приобрести крупные размеры. С повышением величины Dt скорость роста числа центров кристаллизации Vчц (кривая 1)становится намного больше, чем Vск, из-за чего размер зерен получается небольшим.
С дальнейшим ростом скорости охлаждения и величины Dt скоростные показатели процесса кристаллизации уменьшаются, приближаясь к нулю. При определенных условиях, как было показано выше, может произойти застывание металла с образованием аморфной структуры.
Таким образом, увеличивая скорость охлаждения жидкого металла, можно формировать его мелкокристаллическую структуру и тем самым повышать механические свойства. При этом средняя площадь сечения S получаемых зерен приближенно определяется выражением: S= 1,1 (Vск/Vчц)3/4.
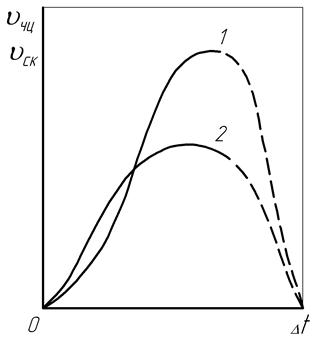
Рис. 14. Зависимость скорости роста числа центров кристаллизации Vчц (1) и скорости увеличения размера зерен Vск (2) от степени переохлаждения
В реальных условиях получения металла, кроме этого, применяется метод модифицирования структуры путем введения в расплав добавок-модификаторов, образующих нерастворимые частицы в роли центров кристаллизации, либо за счет добавления растворимых поверхностно-активных веществ, замедляющих скорость роста кристаллов. В качестве модификаторов используются Al, V, Ti, B, Na в количестве нескольких сотых долей процента.
|
|
Дата добавления: 2014-10-31; Просмотров: 847; Нарушение авторских прав?; Мы поможем в написании вашей работы!