
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
|
|
|
|
ЛЕКЦИЯ 25. ЗАЩИТА МЕТАЛЛОВ ОТ ХИМИЧЕСКОЙ КОРРОЗИИ
1) Защита от газовой коррозии
а) Основной метод – применение жаростойких и жаропрочных материалов.
Жаростойкость - стойкость по отношению к газовой коррозии при
высоких температурах.
Жаропрочность - свойства конструкционного материала сохранять
высокую механическую прочность при значительном повышении
температуры.
Жаростойкость → легирование, например, стали хромом, алюминием и кремнием. Эти элементы при высоких температурах образуют плотные защитные пленки оксидов: FeCr2O4, NiFe2O4, NiCr2O4
Стали, легированные 4 - 9% хрома, молибденом или кремнием, используются в парогенераторо- и турбостроении.
Сплав, содержащий 9 - 12% хрома, - для изготовления лопаток газовых турбин, деталей реактивных двигателей, в производстве двигателей внутреннего сгорания и т. п.
Сплавы Сr-Al-Fе обладают исключительно высокой жаростойкостью. Например, сплав, содержащий 30% Сr, 5% Аl, 0,5% Si, устойчив на воздухе до 1300°С. Эти сплавы используют, в частности, в качестве материалов для изготовления спиралей и деталей нагревательных элементов печей сопротивления.
Нихромы 80% Ni и 20% Cr или 65% Ni + 20% Cr+ 15% Fe обладают высокой жаростойкостью
Но: V, Mo, W образуют легкоплавкие и летучие оксиды, ускоряют окисление стали при высоких Т.
Например, сплавы, сод. 4-9% Si, Cr, Mo применяют в парогенераторо- и турбостоении; 9-12% Cr - для изготовления лопаток газовых турбин, деталей реактивных двигателей, двигателей внутреннего сгорания.
Сплав, содержащий 30% Cr, 5% Al, 0,5% Fe – устойчив на воздухе при t > 13000С.
в) воздействие на среду, уменьшение Р газа, подбор Т, использование инертных и защитных газовых атмосфер
с) выбор защитных покрытий (керамических и металлокерамических)
2) защита от коррозии в продуктах сгорания топлива
а) подбор коррозионностойких, жаропрочных материалов (наименее подвержены ванадиевой коррозии стали и сплавы, легированные Al, а сульфидно-оксидной –стали и сплавы, легированные Cr)
б) совершенство условий эксплуатации (↓ Т ↓ р г и отсутствие контакта)
3) защита от коррозии в неэлектролитах
а) выбор коррозионностойких материалов
б)применение защитных покрытий на М.Так, используют Al- Sn- покрытия стали (Fe) при контакте с нефтепродуктами, содержащими S и О2 (пленка Al2O3 не реагирует с S до 2000С, а Sn не реагирует с О2 и S до 150 0С
в) чистота используемых рабочих жидкостей (удаление S, O2, Н2О)
г) введение в среду ингибиторов - антикоррозионных присадок.
Пример 1. Определите термодинамическую возможность газовой коррозии изделия из низкоуглеродистой стали (Fe) эксплуатирующегося при 700 К в среде водяного пара ( = 10).
= 10).
Решение. Коррозия может быть вызвана процессом:
Fe(т) + Н2О(г) → FeO(т) + Н2(г) и имеет место, если 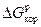 < 0.
< 0.
Рассчитаем энергию Гиббса процесса:
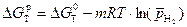
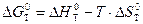
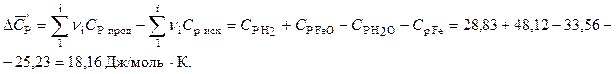
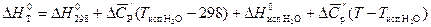 .
.
Воспользуемся справочными данными:
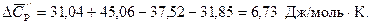
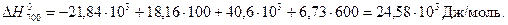
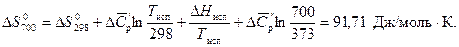
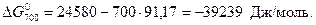
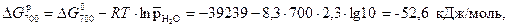
т.е. газовая коррозия Fe в данных условиях возможна.
Пример 2. Определите относительное парциальное давление водяного пара, при котором прекращается газовая коррозия изделия из низкоуглеродистой стали при 700 К.
Решение. Газовая коррозия прекращается, когда 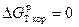 или
или  . Отсюда:
. Отсюда:
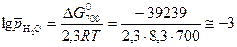 ;
;
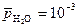 .
.
Пример 3. Определите температуру, при которой газовая коррозия изделия (пример 1) при стандартных условиях прекратится.
Решение. С некоторыми допущениями температуру, при которой прекращается коррозия, найдем из уравнения:
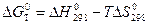 , откуда
, откуда 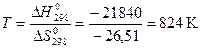 ,
,
т.е. в среде водяного пара газовая коррозия Fe прекращается при Т ≤824 К.
Пример 4. Определите термодинамическую возможность электрохимической коррозии сплава Cu-Zn в водном растворе ZnSO4 c концентрацией соли 0,01 моль/л при 25º С и
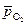 = 0,21, приняв
= 0,21, приняв 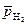 = 1. Составьте уравнения процессов, протекающих при коррозии.
= 1. Составьте уравнения процессов, протекающих при коррозии.
Решение. Рассчитаем рН раствора с учетом гидролиза соли, образованной слабым основанием и сильной кислотой [1]:
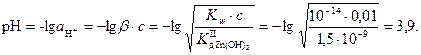
Равновесные потенциалы возможных окислителей равны:
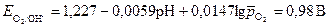 ;
;
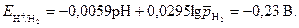
Анодными участками в данном сплаве являются цинковые 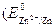 <
<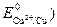 . Так как Е ох>
. Так как Е ох>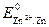 , то коррозия данного сплава термодинамически возможна.
, то коррозия данного сплава термодинамически возможна.
Анодный процесс: Zn → Zn2+ + 2 e
Катодные процессы: 2Н+ +2 е → Н2; О2 +4Н+ + 4 е → 2 Н2О.
Пример 5. Выразите скорость равномерной коррозии стального (Fe) изделия через массовый показатель К m, г/(м2·год), если плотность коррозионного тока составляет 0,01 А/м2.
Решение. Из закона Фарадея: m кор.Fe= M э I к t/F. Скорость коррозии равна:
 , где
, где
М э – молярная масса эквивалента, г
F – число Фарадея, 96500 Кл
I к – сила коррозионного тока, А
М эFe = 56/2=28 г/моль.
К m =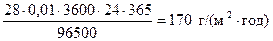
Пример 6. При коррозии железного изделия за 1,5 мин работы коррозионного ГЭ образовалось 0,125 г Fe(OH)2. Вычислите объем кислорода, израсходованного на коррозия железа, силу коррозионного тока и масса растворенного металла.
Решение. Запишем уравнения процессов, протекающих в коррозионном ГЭ:
А: Fe → Fe2+ + 2 e
К: О2 + 2Н2О + 4 е → 4ОН-
Рассчитаем количество моль-эквивалентов образовавшегося Fe(OH)2:
n э Fe(OH)2= m Fe(OH)2/ M э Fe(OH)2 = 0,125/45 = 2,8·10-3.
Согласно закону эквивалентов все вещества взаимодействуют в эквивалентных количествах, т.е. n э Fe(OH)2 = n э Fe = n э О2 =2,8·10-3.
Тогда объем кислорода, израсходованного на коррозию железа:
V О2 = n э О2· V э О2 = 2,8·10-3·5,6 = 15,7·10-3 л = 15,7 мл.
По закону Фарадея рассчитаем силу коррозионного тока в ГЭ:
I = V О2· F /(V э О2 · t) = 15,7·10-3·96500/(5,6·90) = 3 А
Определим массу растворившегося Fe:
m Fe = n э Fe · M э Fe = 2,8·10-3·28 = 0,08 г.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1959; Нарушение авторских прав?; Мы поможем в написании вашей работы!