
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм действия ферментов
|
|
|
|
Классификация и номенклатура ферментов
Кофермент ацетилирования (коэнзим А, или просто КоА)
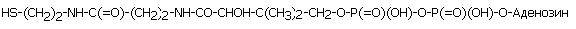
Участвует в реакциях активации и переноса ацетильных и ацильных групп (присоединяется к S- в составе КоА, с образованием ацетил-коА).
Всего в клетке насчитывают около 10000 ферментов, которые катализируют около 2000 реакций. Известно 1800 ферментов, из них 150 выделены в кристалличнском виде.
По классификации ферментов (КФ- русскоязычная, ЕС-англоязычная) каждый фермент (энзим) имеет свой определенный номер, состоящий из четырех групп цифр, разделенных точками. Первая цифра обозначает отнесение фермента к классу, вторая - к подклассу, третья - к подподклассу и, наконец, четвертая- номер фермента. Например, шифр алкогольдегидрогеназы ADH по классификации - ЕС 1.1.1.1, малатдегидрогеназы- ЕС 1.1.1.37. Разделение ферментов на классы строгое и не допускает произвольного изменения номеров. Так, все оксидоредуктазы относят к первому классу, трансферазы - ко второму, гидролазы- к третьему и т.д.
Таблица 8 - Классификация и номенклатера ферментов
| Класс | Реакции | Основные подклассы, группы. |
| Оксидоредуктазы. | Окислительно-восстановительные реакции. Авосст + Вокис → Аокис + Ввосст | Дегидрогеназы, оксидазы, редуктазы, гидроксилазы: никотинамидадениндинуклеотид (НАД), тиаминпирофосфат, флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). |
| Трансферазы | Перенос групп А-В + С → А + В-С | Киназы (фосфатные группы), трансаминазы (аминогруппы) |
| Гидролазы | Гидролиз связей (эфирных, пептидных, гликозидных связей С-С, Р-N) А-В + Н2О → А-Н + В-ОН | Эстеразы, фосфотазы, протеазы, липазы, нуклеазы, тиолазы |
| Лиазы | Разрыв связей С-С, С-О, С- N, С- S путем элиминирования молекулы с образованием двойных связей. В обратной реакции ускоряют присоединение воды, аммиака и т.д. по двойной связи А(ХН) – В → А-Х + В –Н | Альдегидлиазы, (альдолазы), углерод-кислородлиазы (фумараза), дегидратазы (енолаза), декарбоксилазы |
| Изомеразы | Взаимопревращения изомеров А↔ Изо -А | Изомеразы, мутазы. |
| Лигазы (синтетазы) | Соединение двух молекул, сопряженное с гидролизом АТФ А + В+ АТФ →А – В + АДФ + Ф | Карбоксилазы, синтетазы |
Классификация ферментов: четырехчисловая система, первое число - класс (один из шести). Внутри каждого класса происходит разделение на подклассы, например, внутри первого класса различают:
EC 1.1 Действующие на CH-OH группы донора
EC 1.2 Действующие на альдегидные или оксо- группы донора
EC 1.3 Действующие на CH-СH группы донора
EC 1.4 Действующие на CH-NH2 группы донора
EC 1.5 Действующие на CH-NH группы донора
EC 1.6 Действующие на NADH или NADPH
Внутри каждого подкласса происходит разделение на подподклассы:
EC 1.1.1 Акцептор NAD или NADP
EC 1.1.2 Акцептор- цитохром
EC 1.1.3 Акцептор- кислород
EC 1.1.4 Акцептор- сульфид
EC 1.1.5 Акцептор- хинон или подобная группировка
EC 1.1.99 Другой акцептор
Последнее число – номер конкретного энзима:
EC 1.1.1. 1 alcohol dehydrogenase
EC 1.1.1. 2 alcohol dehydrogenase (NADP+)
EC 1.1.1. 3 homoserine dehydrogenase
EC 1.1.1. 4 (R,R)-butanediol dehydrogenase
EC 1.1.1. 5 acetoin dehydrogenase ... и т. д.
Ферменты, кроме того, имеют названия, которые разделяются на рабочие и систематические. Рабочие названия образуются из объединения названия субстрата, типа реакции и окончания "-аза". Например: ЛАКТАТ + ДЕГИДРОГЕНизация + АЗА = ЛАКТАТДЕГИДРОГЕНАЗА. Систематическое название фермента формируется следующим образом: (название субстратов (через дробь), название типа химического превращения + аза). Та же лактатдегидрогеназа будет иметь систематическое название " L-лактат:NAD+ оксидоредуктаза ".
Структура и функции ферментов, а также механизм их действия почти ежегодно подробно обсуждаются на многих международных симпозиумах и конгрессах. Важное место отводится рассмотрению структуры всей молекулы фермента и ее активных центров, молекулярному механизму действия различных типов ферментов, общей теории энзиматического катализа. Тем не менее, до сих пор нет полной ясности по двум кардинальным проблемам энзимологии: чем вызваны специфичность действия и высокая каталитическая эффективность ферментов?
После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе фермент Е соединяется (в принципе обратимо) со своим субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р. Благодаря высокому сродству связывания и образованию ES-комплекса резко возрастает число молекул субстрата, вступающих в реакции. Эти представления легли в основу теории «ключа-замка» Э. Фишера, которую иногда называют теорией «жесткой матрицы». Таким образом, жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента.
Л. Михаэлис не только постулировал образование промежуточного фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации субстрата на скорость реакции. В процессе реакции различают несколько стадий: присоединение молекулы субстрата к ферменту, преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов и протекающее в одну или несколько стадий отделение конечных продуктов реакции от фермента. Это можно схематически проиллюстрировать следующими примерами:
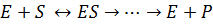
На рис. 13 представлена схема образования промежуточного фермент-субстратного комплекса. Если фермент в активном центре содержит кофермент, то предполагается образование тройного комплекса (рис. 14).
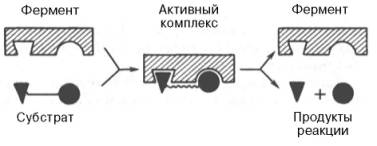
Рисунок 13 - Образование нестойкого фермент-субстратного комплекса согласно теории Э. Фишера «ключ-замок»
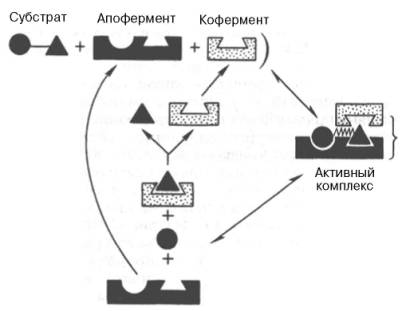
Рисунок 14 - Функция кофермента (по А. Кантарову и Б. Шепартцу)
Фермент вступает во взаимодействие с субстратом на очень короткий период, поэтому долгое время не удавалось показать образование такого комплекса. Прямые доказательства существования фермент-субстратного комплекса были получены в лабораториях Д. Кейлина и Б. Чанса. В настоящее время экспериментальные и математические методы кинетики, термодинамики и статической механики химических реакций позволяют определить для ряда
ферментативных реакций кинетические и термодинамические показатели, в частности константы диссоциации промежуточных фермент-субстратных комплексов, константы скорости и равновесия их образования.
В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи.
Для каталитической активности фермента существенное значение имеет пространственная структура, в которой жесткие участки α-спиралей чередуются с гибкими, эластичными линейными отрезками, обеспечивающими динамические изменения белковой молекулы фермента. Этим изменениям придается большое значение в некоторых теориях ферментативного катализа. Так, в противоположность модели Э. Фишера «ключ-замок» Д. Кошлендом была разработана теория «индуцированного соответствия». На рис. 15 видно, что присоединение субстрата S к ферменту Е, вызывая соответствующие изменения конформации активного центра, в одних случаях приводит к образованию активного комплекса, в других – неактивного комплекса вследствие нарушения пространственного расположения функциональных групп активного центра в промежуточном комплексе.
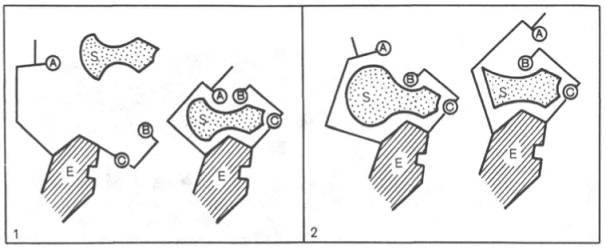
А, В, С - функциональные группы активного центра; 1 - активный комплекс; 2 - неактивный комплекс
Рисунок 15 - Изменения структуры активного центра фермента, вызванные субстратом, согласно модели «индуцированного соответствия» Д. Кошленда.
В каталитическом процессе существенное значение имеют точное соответствие между ферментом и субстратом, а также термодинамические и каталитические преимущества подобного соответствия. Гипотеза «индуцированного соответствия» предполагает существование между ферментом и субстратом не только пространственной или геометрической комплементарности, но и электростатического соответствия, обусловленного спариванием противоположно заряженных групп субстрата и активного центра фермента. Точное соответствие обеспечивает образование эффективного комплекса между субстратом и ферментом.
Подобно другим катализаторам, ферменты, с термодинамической точки зрения, ускоряют химические реакции за счет снижения энергии активации. Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активированное состояние при данной температуре. Другими словами, это энергия, необходимая для запуска химической реакции, без которой реакция не начинается, несмотря на ее термодинамическую вероятность. Фермент снижает энергию активации путем увеличения числа активированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне (рис. 16).
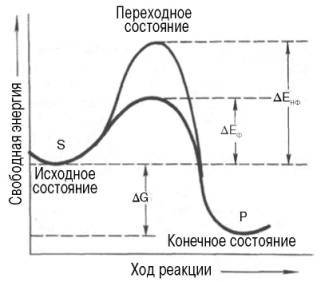
S - исходный субстрат; Р - продукт; ΔЕНФ -энергия активации неферментативной реакции; ΔЕФ - энергия активации ферментативной реакции; ΔG - стандартное изменение свободной энергии
Рисунок 16 - Энергетический механизм ферментативной и неферментативной химических реакций
На рисунке видно, что ферментативная реакция имеет более низкую энергию активации. Следует отметить, что как катализируемая ферментом, так и не катализируемая им реакция независимо от ее пути имеет одинаковую величину стандартного изменения свободной энергии (ΔG). Действуя на скорость реакции, ферменты не изменяют равновесия между прямой и обратной реакциями, как и не влияют на величину свободной энергии реакции; они лишь ускоряют наступление равновесия химической реакции.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1390; Нарушение авторских прав?; Мы поможем в написании вашей работы!