
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулярный механизм действия металлов в энзиматическом катализе, или роль металлов в активировании ферментами
|
|
|
|
Активирование и ингибирование ферментов
Скорость ферментативной реакции, как и активность фермента, в значительной степени определяется также присутствием в среде активаторов и ингибиторов: первые повышают скорость реакции, а вторые тормозят эту реакцию. Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Так, соляная кислота активирует действие пепсина желудочного сока; желчные кислоты повышают активность панкреатической липазы; некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), растительная протеиназа и др. в значительной степени активируются соединениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд ферментов – также витамином С. Особенно часто активаторами выступают ионы двухвалентных и, реже, одновалентных металлов. Получены доказательства, что около четверти всех известных ферментов для проявления полной каталитической активности нуждаются в присутствии металлов. Многие ферменты вообще не активны в отсутствие металлов. Так, при удалении цинка угольная ангидраза (карбоангидраза), катализирующая биосинтез и распад Н2СО3, практически теряет свою ферментативную активность; более того, цинк при этом не может быть заменен никаким другим металлом. Известны ферменты, действие которых активируется ионами нескольких металлов; в частности, енолаза активируется Mg2+, Mn2+, К+ (табл. 9).
Таблица 9 - Ферменты, активируемые металлами
| Фермент | Металл | Фермент | Металл |
| Цитохромы | Fe | Амилаза | Ca |
| Каталаза | Fe | Липаза | Ca |
| Пероксидаза | Fe | Карбоангидраза | Zn |
| Триптофаноксидаза | Fe | Уриказа | Zn |
| Аскорбиноксидаза | Cu | Карбоксипептидаза | Zn |
| Тирозиназа | Cu | Пируваткарбоксилаза | Mg |
| Альдегидоксидаза | Mo | Фосфатаза | Mg |
| Холинэстераза | Mn | Аргиназа | Mn |
В ряде случаев ионы металлов (Со2+, Mg2+, Zn2+, Fe2+) выполняют функции простетических групп ферментов, или служат акцепторами и донаторами электронов. В других случаях они способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса. Например, ионы Mg2+ через отрицательно заряженную фосфатную группу обеспечивают присоединение монофосфатных эфиров органических веществ к активному центру фосфатаз, катализирующих гидролиз этих соединений. Иногда металл соединяется с субстратом, образуя истинный субстрат, на который действует фермент. В частности, ионы Mg2+активируют креатинфосфокиназу благодаря образованию истинного субстрата – магниевой соли АТФ. Наконец, имеются экспериментальные доказательства прямого участия металлов (например, ионов Са2+ в молекуле амилазы слюны) в формировании и стабилизации активного центра и всей трехмерной структуры молекулы фермента.
Анионы в физиологических концентрациях обычно неэффективны или оказывают небольшое активирующее влияние на ферменты. Исключение составляют пепсин, некоторые оксидоредуктазы, активируемые анионами, а также амилаза слюны, катализирующая гидролиз крахмала, активность которой повышается при действии ионов хлора, и аденилатциклаза, которая активируется анионами галогенов.
Активаторы ферментов. Ферменты-протеинкиназы имеют четвертичную структуру, состоят их 2-х субъединиц - каталитической и регуляторной. Активатор воздействует на регуляторную, а в результате обнажается каталитическая субъединица:
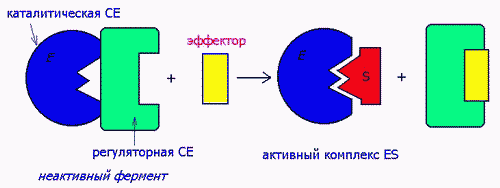
Рисунок 21 - Воздействие активатора
Кооперативный эффект. Характерен для ферментов, имеющих 2 и более субъединиц. Присоединение субстрата к одной из субъединиц облегчает последующие присоединения к оставшимся субъединицам. Типичный пример кооперативного эффекта - перенос кислорода молекулами гемоглобина.
Ингибиторы ферментов обычно принято делить на два больших класса: обратимые и необратимые. Это вещества, вызывающие частичное (обратимое) или полное торможение реакций, катализируемых ферментами. Недавно открыты антиферменты (антиэнзимы), представляющие собой белки (или полипептиды), действующие как ингибиторы ферментов. К подобным веществам относятся, например, ингибитор трипсина, обнаруженный в соевых бобах, и сывороточный антитрипсин. Недавно открыт в печени животных антифермент орнитиндекарбоксилазы. Антиэнзимы, вероятнее всего, образуют труднодиссоциируемые комплексы с соответствующими ферментами, выключая их из химических реакций. Иногда ингибитор является составным компонентом предшественника фермента или входит в состав сложных комплексов ферментов, например в состав протеинкиназы и протеинфосфатазы, катализирующих процессы фосфорилирования-дефосфорилирования в живых организмах.
Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка (кислоты, щелочи, соли тяжелых металлов, нагревание), приводят к необратимой инактивации фермента. Однако подобное инак-тивирование относительно неспецифично, оно не связано с механизмом действия ферментов. Гораздо большую группу составляют так называемые специфические ингибиторы, которые оказывают свое действие на какой-либо один фермент или группу родственных ферментов, вызывая обратимое или необратимое ингибирование. Ингибиторы могут дать ценную информацию о химической природе активного центра фермента, а также о составе его функциональных групп и природе химических связей, обеспечивающих образование фермент-субстратного комплекса.
Действие ряда ферментов (холинэстераза, трипсин и химотрипсин) сильно тормозится некоторыми фосфорорганическими соединениями, например ДДТ, вследствие блокирования ключевой гидроксильной группы серина в активном центре.
При помощи ингибиторов, выключающих отдельные стадии многоступенчатого метаболического процесса, могут быть точно установлены не только последовательность химических реакций, но и природа участвующих в этих превращениях ферментов. Этим путем, применяя йодацетат, фториды и другие специфические ингибиторы, был расшифрован гликолитический путь окислительно-восстановительных превращений глюкозы до стадии образования молочной кислоты в мышечной ткани, насчитывающий 11 стадий с участием 11 ферментов и 10 промежуточных метаболитов.
С ингибированием ферментов связан механизм действия многих токсинов и ядов на организм. Известно, что при отравлениях солями сенильной кислоты смерть наступает вследствие полного торможения и выключения дыхательных ферментов (цитохромная система) тканей, особенно клеток мозга. Токсическое влияние на организм человека и животных некоторых инсектицидов обусловлено торможением активности холинэстеразы – фермента, играющего ключевую роль в деятельности нервной системы.
Современная, так называемая рациональная, химиотерапия (направленное применение лекарственных препаратов в медицине) должна основываться на точном знании механизма действия лекарственных средств на биосинтез ферментов, на активность уже синтезированных ферментов или на регуляцию их активности в организме. Иногда для лечения некоторых болезней используют избирательно действующие ингибиторы. Так, ингибитор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол широко применяется для лечения острого панкреатита – болезни, при которой уровень трипсина и химотрипсина в крови резко возрастает. Знание избирательного ингибиторного действия некоторых природных и синтетических соединений (так называемых антиметаболитов) на ферменты может служить методологической основой для разработки эффективных методов синтеза химиотерапевтических препаратов. Этот путь открывает широкие возможности для направленного воздействия на синтез ферментов в организме и регуляции интенсивности метаболизма при патологии.
Типы ингибирования. Различают обратимое и необратимое ингибирование. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым.
Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую:
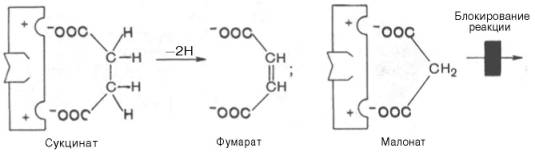
Если в среду добавить малонат (ингибитор), то в результате структурного сходства его с истинным субстратом сукцинатом (наличие двух таких же ионизированных карбоксильных групп) он будет взаимодействовать с активным центром с образованием фермент-ингибиторного комплекса, однако при этом полностью исключается перенос атома водорода от малоната. Структуры субстрата (сукцинат) и ингибитора (малонат) все же несколько различаются. Поэтому они конкурируют за связывание с активным центром, и степень торможения будет определяться соотношением концентраций малоната и сукцината, а не абсолютной концентрацией ингибитора. Таким образом, ингибитор может обратимо связываться с ферментом, образуя фермент-ингибиторный комплекс. Этот тип ингибирования иногда называют ингибированием по типу метаболического антагонизма (рис. 22).

Е - фермент; S - субстрат; Р1 и Р2 - продукты реакции; I - ингибитор
Рисунок 22 - Действие конкурентного ингибитора (схема по В.Л. Кретовичу)
В общей форме реакция взаимодействия ингибитора с ферментом может быть представлена следующим уравнением:

Образовавшийся комплекс, называемый фермент-ингибиторным комплексом ЕI, в отличие от фермент-субстратного комплекса ES не распадается с образованием продуктов реакции. Константу диссоциации комплекса EI, или ингибиторную константу К i, можно, следуя теории Михаэлиса–Ментен, определить как отношение констант обратной и прямой реакций:

т.е. ингибиторная константа прямо пропорциональна произведению концентрации фермента и ингибитора и обратно пропорциональна концентрации комплекса EI.
Метод конкурентного торможения нашел широкое применение в медицинской практике. Известно, например, что для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Оказалось, что эти препараты имеют структурное сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, являющейся составной частью ферментов бактерий. Благодаря этому структурному сходству сульфаниламид блокирует действие фермента путем вытеснения парааминобензойной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту, что ведет к торможению роста бактерий.
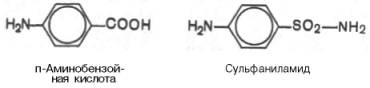
Некоторые аналоги витамина В6 и фолиевой кислоты, в частности дезоксипиридоксин, действуют как конкурентные, так называемые коферментные, ингибиторы (или антивитамины), тормозящие многие интенсивно протекающие при патологии биологические процессы в организме. Применение подобных аналогов в медицинской практике (в частности, в дерматологии и онкологии) основано на конкурентном вытеснении коферментов из субстратсвязывающих центров ключевых ферментов обмена.
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примером необратимого ингибирования является действие йодацетата, ДФФ, а также диэтил- n -нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов и молекуле фермента.
Следует указать, что неконкурентное ингибирование также может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр. Примеры необратимого ингибирования приведены ранее. При обратимом неконкурентном ингибировании субстрат S и ингибитор I связываются с разными центрами, поэтому появляется возможность образования как комплекса EI, так и тройного комплекса EIS; последний может распадаться с освобождением продукта, но с меньшей скоростью, чем комплекс ES.

Этот тип неконкурентного ингибирования чаще всего наблюдается у ферментов, катализирующих превращения более одного субстрата, когда связывание ингибитора не блокирует связывание субстрата с активным центром. Ингибитор при этом соединяется как со свободным ферментом, так и с ES-комплексом.
Известно, кроме того, так называемое бесконкурентное ингибирование, когда ингибитор связывается с ферментом также в некаталитическом центре, однако не со свободным ферментом, а только с ES-комплексом в виде тройного комплекса.

Мультимолекулярные ферментные системы. Особую группу ферментов составляют надмолекулярные (или мульти-молекулярные) ферментные комплексы, в состав которых входят не субъединицы (в каталитическом отношении однотипные протомеры), а разные ферменты, катализирующие последовательные ступени превращения какого-либо субстрата. Отличительными особенностями подобных мультиферментных комплексов являются прочность ассоциации ферментов и определенная последовательность прохождения промежуточных стадий во времени, обусловленная порядком расположения каталитически активных (различных) белков в пространстве («путь» превращения в пространстве и времени). Типичными примерами подобных мультиферментных комплексов являются пируватдегидрогеназа и α-кетоглутаратдегидрогеназа, катализирующие соответственно окислительное декарбоксилирование пировиноградной и α-кетоглутаровой кислот в животных тканях, и синтетаза высших жирных кислот. Молекулярные массы этих комплексов в зависимости от источника их происхождения варьируют от 2,3•106 до 10•106.
Ряд таких мультиферментных комплексов, иногда называемых ферментными ансамблями, структурно связанных с какой-либо органеллой (рибосомы, митохондрии) или с биомембраной и составляет высокоорганизованные надмолекулярные системы, обеспечивающие жизненно важные функции, например, тканевое дыхание (перенос электронов от субстратов к кислороду через систему дыхательных ферментов).
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1025; Нарушение авторских прав?; Мы поможем в написании вашей работы!