
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обмен гемоглобина
|
|
|
|
Из различных хромопротеинов наибольшее значение имеет гемоглобин. Поступающий с пищей гемоглобин в желудочно-кишечном тракте распадается на составные части – глобин и гем. Глобин как белок, гидролизуется на аминокислоты. Гем окисляется в гематин и выводится с калом. Таким образом, гемоглобин пищи не участвует в интенсивном метаболизме эндогенного гемоглобина. Уровень метаболизма эндогенного гемоглобина определяется тем, что период жизни эритроцита равен 126 дней, т.е. ежечасно обновляется примерно 6*109 эритроцитов, а, следовательно, и гемоглобина.
Строение гемоглобина. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина.
Основу структуры простетической группы большинства гемосодержа-щих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов, соединенных между собой метиновыми мостиками (—СН=).

Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем.
Из формулы видно, что железо связано с двумя атомами азота молекулы протопорфирина ковалентно и с двумя другими – координационными связями, обозначенными пунктирными линиями.
Гем в виде гемпорфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c 1.
Структурная организация гемоглобина (и миоглобина) была расшифрована Дж. Кендрью и М. Перутц (Нобелевская премия 1962 г.). Дыхательная функция гемоглобина крови подробно рассматривается в курсе физиологии. Здесь следует указать на уникальную роль гемоглобина в траспорте кислорода от легких к тканям и диоксида углерода от тканей к легким. Это элементарное проявление жизни – дыхание, хотя и выглядит простым, основано на взаимодействии многих типов атомов в гигантской молекуле гемоглобина. Подсчитано, что в одном эритроците содержится около 340000000 молекул гемоглобина, каждая из которых состоит примерно из 103 атомов С, Н, О, N, S и 4 атомов железа.
Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле гемоглобина взрослого человека HbА (от англ. adult – взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин. Две из них, называемые α-цепями, имеют одинаковую первичную структуру и по 141 аминокислотному остатку. Две другие, обозначаемые β-цепями, также идентично построены и содержат по 146 аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина состоит из 574 аминокислот. Во многих положениях α- и β-цепи содержат разные аминокислотные последовательности, хотя и имеют почти одинаковые пространственные структуры. Получены доказательства, что в структуре гемоглобинов более 20 видов животных 9 аминокислот в последовательности оказались одинаковыми, консервативными (инвариантными), определяющими функции гемоглобинов; некоторые из них находятся вблизи гема, в составе участка связывания с кислородом, другие – в составе неполярной внутренней структуры глобулы.

Рисунок 31 Координационные связи атома железа в молекуле гема. Все 4 связи с атомами азота пиррольных колец расположены в одной плоскости, 5-я и 6-я координационные связи (с атомом азота имидазольного кольца гистидина и с кислородом соответственно) – по разные стороны перпендикулярно к этой плоскости
В дополнение к основному гемоглобину HbA1в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НbА2, также состоящего из 4 субъединиц: двух α-цепей и двух δ-цепей. На долю НbА2 приходится около 2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей. Фетальный гемоглобин отличается от HbA1не только составом аминокислот, но и физико-химическими свойствами: спектральным показателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на НbА (все же в крови взрослого человека открывается до 1,5% HbF от общего количества гемоглобина). Последовательность аминокислот в γ- и δ-цепях гемоглобинов окончательно не расшифрована.
Обмен гемоглобина. Как синтез, так и распад гемоглобина происходит в селезенке, печени, косном мозге.
Распад гемоглобина начинается с окисления гема, когда железо Fе2+ превращается в Fе3+. Образующееся соединение называется вердоглобином (вещество зеленого цвета), который спонтанно распадается на составные части – глобин, железо и оставшаяся часть гема – биливердин (пигмент зеленого цвета). Биливердин восстанавливается в желто-красный билирубин, который поступает в печень. Для организма билирубин является токсичным и водонерастворимым. Поэтому в местах его образования происходит его обезвреживание и превращение в водорастворимую форму. Этот процесс происходит двумя путями:
1 С помощью глюкуроновой кислоты с которой билирубин образует моно- или диглюкурониды, комплекс билирубина с одной или двумя молекулами глюкуроновой кислоты. Такой билирубин является связанным (в лабораторной практике – прямой билирубин).
2 Образование комплекса с альбумином. В этом случае билирубин называют свободным (непрямым).
В крови содержится около 75% свободного билирубина и 25% связанного.
В печени комплекс билирубина с белками распадается, и освободившийся билирубин превращается в глюкуронид. В печени весь билирубин присутствует в форме связанной с глюкуроновой кислотой, т.е. в нетоксичной и водорастворимой форме. Из печени билирубин поступает в желчный пузырь, откуда под влиянием желчного пигмента поступает в кишечник. Там билирубин освобождается от глюкуроновой кислоты и подвергается различным превращениям с образованием в конце уробилиногена и стеркобилиногена. Первый всасывается в кровь, затем в печень, откуда поступает в мочу. На воздухе уробилиноген окисляется в уробилин. Второй выводится с калом (специфическая окраска) и кислородом окисляется до стрекобилина.
Синтез гемоглобина состоит из двух процессов:
1 синтез гема из глицина, янтарной кислоты и железа.
2 конденсация с глобином
Н2О
N N N N
- Н2О
Fе2+ Fе2+ + О2
| глобин |
Гем Миоглобин
О2
N N
Fе2+
| глобин |
Гемоглобин состоит из четырех полипептидных цепей, аналогичных по строению миоглобину.
В лекгих
ННb(Fе2+) + О2 ННbО2 (Fе2+)
В тканях
Оксигемоглобин выполняет функцию транспорта кислорода. Благодаря ему, литр крови переносит 250 мл кислорода в различные органы. Здесь оксигемоглобин отдает кислород, который диффундируют через плазму и стенки капилляров в ткани.
СО О2
ННbСО ННb ННb О2
карбокигемоглобин Н2О оксигемоглобин
СО2
(ННb СО2)- Нb- НbО2
Анион анион анион
карбаминогемоглобина гемоглобина оксигемоглобина
Из многообразия производных гемоглобина, следует, прежде всего, указать на оксигемоглобин НbО2 – соединение молекулярного кислорода с гемоглобином. Кислород присоединяется к каждому гему молекулы гемоглобина при помощи координационных связей железа, причем присоединение одной молекулы кислорода к тетрамеру облегчает присоединение второй молекулы, затем третьей и т.д. Помимо кислорода, гемоглобин легко соединяется с другими газами, в частности с СО, NO и др. Так, при отравлении оксидом углерода гемоглобин прочно связывается с ним с образованием карбоксигемоглобина (НbСО). При этом вследствие высокого сродства к СО гемоглобин теряет способность связывать кислород и наступает смерть от удушья, недостаточного снабжения тканей кислородом При этом содержание его в крови в 210 раз больше, чем оксигемоглобина, поэтому наступает отравление угарным газом.. Однако при быстром повышении парциального давления кислорода во вдыхаемом воздухе можно добиться частичного вытеснения СО из связи с гемоглобином и предотвратить летальный исход. Норма содержания карбоксигемоглобина – 0,3 – 05%, у курильщиков – 4,7%. При легкой тяжести отравления – 10-15% - головная боль, слабость, тошнота. При средней – 25-30% - нарушение координации, синюшность лица и помутнение сознания. При тяжелых – 60% и более – потеря сознания и смерть.
При отравлении оксидами азота, парами нитробензола и другими соединениями часть гемоглобина окисляется в метгемоглобин (НbОН), содержащий трехвалентное железо. Метгемоглобин также теряет способность к переносу кислорода от легких к тканям, поэтому при метгемоглобинемии (вследствие отравления окислителями) в зависимости от степени отравления может наступить смерть от недостатка кислорода. Если вовремя оказать помощь, т.е. повысить парциальное давление кислорода (вдыхание чистого кислорода), то и в этом случае можно вывести больного из опасного состояния.
Установление первичной структуры субъединиц молекулы гемоглобина стимулировало исследования по расшифровке структуры так называемых аномальных гемоглобинов. В крови человека в общей сложности открыто около 150 различных типов мутантных гемоглобинов. Появляются мутантные формы гемоглобинов в крови вследствие мутации генов. Обычно мутации делят на 3 класса в соответствии с топографией измененного участка молекулы. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса; подобные мутации обычно не сопровождаются развитием тяжелой патологии, и болезнь протекает бессимптомно; исключение составляет серповидно-клеточная анемия. При замене аминокислоты вблизи гема нарушается связывание кислорода – это мутация второго класса, сопровождающаяся развитием болезни. И наконец, если замена происходит во внутреннем участке молекулы гемоглобина, говорят о третьем классе мутации; подобные мутации приводят к нарушению пространственной структуры и соответственно функции гемоглобина.
Аномальные гемоглобины, различающиеся по форме, химическому составу и величине заряда, были выделены при помощи электрофореза и хроматографии. Передающиеся по наследству изменения чаще всего являются результатом мутации единственного триплета, приводящей к замене одной какой-либо аминокислоты в полипептидных цепях молекулы гемоглобина на другую. В большинстве случаев происходит замена кислой аминокислоты на основную или нейтральную. Поскольку это замещение осуществляется в обеих полипептидных цепях одной из пар (α или β), образовавшийся аномальный гемоглобин будет отличаться от нормального величиной заряда и соответственно электрофоретической подвижностью.
Следует указать, что некоторые мутации, вызывающие существенное изменение структуры и соответственно функции гемоглобина, оказываются летальными, и индивидуумы с подобным гемоглобином умирают в раннем возрасте. Однако при ряде мутаций замена аминокислот не вызывает заметного изменения функции гемоглобина, в этих случаях болезнь протекает бессимптомно.
Болезни гемоглобинов (их насчитывают более 200) называют гемогло-бинозами. Принято делить их на гемоглобинопатии, в основе развития которых, лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии, обусловленные наследственным нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также железодефицитные анемии.
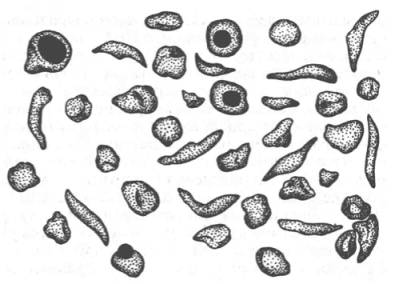
Рисунок 32 -Нормальные и серповидные эритроциты
Классическим примером наследственной гемоглобинопатии является серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа (рис. 32). Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачи кислорода в тканях он превращается в плохо растворимую дезоксиформу и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Болезнь протекает остро, и дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте.
Химический дефект при серповидно-клеточной анемии был раскрыт В. Ингремом и сводится к замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS. Это результат мутации в молекуле ДНК, кодирующей синтез β-цепи гемоглобина. Все остальные аминокислоты располагаются в той же последовательности и в таком же количестве, как и в нормальном гемоглобине НЬА:
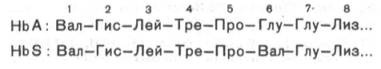
Одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития тяжелой наследственной болезни – серповидно-клеточной анемии.
У беспозвоночных роль переносчика кислорода часто выполняют пигменты негеминовой природы – гемэритрин и гемоцианин. Они не относятся к гемсодержащим хромопротеинам, хотя в их названиях содержится корень «гем». Эти белки, как и гемоглобин, несмотря на то, что выполняют одну и ту же функцию, сильно различаются между собой по молекулярной массе и четвертичной структуре, химической природе активного центра, характеру связывания железа (гемэритрин) и меди (гемоцианин) с кислородом и др.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1273; Нарушение авторских прав?; Мы поможем в написании вашей работы!