
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина 1 страница. Завдання 1. Характерні реакції аніонів першої аналітичної групи
|
|
|
|
Завдання 1. Характерні реакції аніонів першої аналітичної групи
Реакції виявлення аніонів першої аналітичної групи (SO42-, SO32-, S2O32-, CO32-, C2O42-, CrO42-, PO43-, AsO33-, AsO43-, SiO32-, B4O72-, F-)
1.1.Дія групового реагенту (0,5М розчин барію хлориду)
Йони SO42-, SO32-, S2O32-, CO32-, C2O42-, CrO42- (Сr2O72-), PO43-, AsO33-, AsO43-, SiO32-, B4O72-, F- утворюють з 0,5М розчином BaСl2 аморфні осади відповідних солей Барію. Всі осади важко розчиняються у воді, але розчиняються в розведеній хлоридній кислоті, за винятком BaSO4.
Виконання реакцій:
До 0,5 см3 розчину солей, що містять аніони I-ї аналітичної групи, в окремих пробірках додають по 3-4 краплі 0,5М розчину барію хлориду. Зазначте кольори осадів, що утворилися.
1.2. Дія загальних реагентів
1.2.1. Дія аргентуму нітрату
Реагент взаємодіє з аніонами I-ї аналітичної групи з утворенням осадів, які розчиняються в нітратній кислоті.
Виконання реакцій:
У ряд пробірок поміщають по 0,5 см3 солей відповідних аніонів I-ї аналітичної групи і додають по 3-4 краплі реактиву. Зазначте кольори осадів, що утворилися.
1.3. Реакції йонів SO42-
1.3.1. Дія розчинів солей Барію (фармакопейна)
Сульфат-йони з солями Барію утворюють осад барію сульфату білого кольору, який не розчиняється ні в кислотах, ні в лугах. Реакцію проводять в середовищі розбавленої хлоридної кислоти.
Ba2+ + SO42- → BaSO4.
Виконання досліду:
До 0,5-1 см3 розчину, що містить сульфат-йони, додають 10-12 крапель хлоридної кислоти і 5-6 крапель розчину барію хлориду. Інші аніони не перешкоджають виявленню сульфат-йонів.
1.3.2. Дія розчинів солей Стронцію
Сульфат-йони з солями Стронцію утворюють осад стронцію сульфату білого кольору, який не розчиняється ні в кислотах, ні в лугах.
Sr2+ + SO42- → SrSO4.
Виконання досліду:
До 0,5-1 см3 розчину, що містить сульфат-йони, додають 5-6 крапель розчину стронцію хлориду.
1.4. Реакції йонів SO32-
1.4.1. Дія мінеральних кислот
При дії мінеральних кислот на сульфіт-йони утворюється сульфітна кислота, яка розкладається на сульфуру (IV) оксид і воду:
SO32- + 2H+ → H2SO3 → SO2↑ + H2O.
Cульфуру (IV) оксид виявляють за запахом або знебарвленням розчинів йоду або калію перманганату.
SO2 + I2 + 2H2O → 2HI + H2SO4
5SO2 + KMnO4 + 2H2O → 2MnSO4 + K2SO4 + H2SO4
Виконання досліду:
До 0,5 см3 розчину, що містить сульфіт-йони, додають 4-5 крапель 2М розчину хлоридної кислоти. Для виявлення сульфуру (IV) оксиду використовують йодокрохмальний папір.
1.4.2. Дія оксидників
Йод та бром оксидують сульфіти до сульфатів, при цьому відбувається знебарвлення розчинів йоду або брому:
Na2SO3 + I2 + H2O + 2HCl → 2HI + H2SO4 + 2NaCl
Виконання досліду:
До 3-4 крапель розчину натрію сульфіту додають 1-2 краплі розчину хлоридної кислоти і 2-3 краплі розчину йоду. Зазначте аналітичний ефект реакції.
1.5. Реакції йонів S2O32-
1.5.1. Дія мінеральних кислот (фармакопейна)
При дії мінеральних кислот на тіосульфат-йони утворюється тіосульфатна кислота, яка розкладається на сульфуру (IV) оксид, сірку і воду:
S2O32- + 2H+ → H2S2O3 → SO2↑ + H2O + S↓
Виконання досліду:
До 0,5 см3 розчину, що містить натрію тіосульфат, додають 4-5 крапель 2М розчину хлоридної кислоти.
1.5.2. Дія розчину аргентуму нітрату (фармакопейна)
Тіосульфат-йони утворюють з йонами Аргентуму білий осад аргентуму тіосульфату:
Na2S2O3 + 2AgNO3 → Ag2S2O3↓ + 2NaNO3
Виконання досліду:
До 0,5 см3 розчину, що містить натрію тіосульфат, додають 4-5 крапель розчину аргентуму нітрату.
1.6. Реакції йонів СO32-
1.6.1. Дія мінеральних кислот (фармакопейна)
При дії мінеральних кислот на карбонат-йони утворюється карбонатна кислота, яка розкладається на вуглекислий газ і воду:
СO32- + 2H+ → H2СO3 → СO2↑ + H2O
Виконання досліду:
До 10-15 крапель розчину натрію карбонату додають 10 крапель 2М розчину хлоридної кислоти. Пробірку закривають корком з газовивідною трубкою і пропускають газ, що виділяється, крізь вапняну або баритову воду. Зазначте аналітичний ефект реакції.
1.6.2. Дія розчину магнію сульфату (фармакопейна)
Карбонат-йони утворюють з йонами Магнію білий осад магнію карбонату:
СO32- + Mg2+ → MgСO3↓
Виконання досліду:
До 0,5 см3 розчину, що містить натрію карбонат додають 4-5 крапель розчину магнію сульфату.
1.6.3. Дія розчину фенолфталеїну
Розчин карбонату (1:10) при додаванні 1 краплі розчину фенолфталеїну забарвлюється в червоний колір (відмінність від гідрокарбонатів).
1.7. Реакції йонів С2O42-
1.7.1. Дія розчину кальцію хлориду
Оксалат-йони з розчином кальцію хлориду утворюють білий дрібнокристалічний осад кальцію оксалату.
С2O42- + Са2+ → СаС2O4↓
Осад розчиняється в мінеральних кислотах і не розчиняється в ацетатній кислоті.
Виконання досліду:
До 0,5-1 см3 розчину, що містить оксалат-йони, додають і 5-6 крапель розчину кальцію хлориду.
1.7.2. Дія розчину калію перманганату
Оксалат-йони в кислому середовищі знебарвлюють розчин калію перманганату з виділенням вуглекислого газу.
5(NH4)2C2O4 + 2KMnO4 + 8H2SO4 → 2MnSO4 + K2SO4 +
5(NH4)2SO4 + 10CO2 + 8H2O
Виконання досліду:
До 0,5 см3 розчину амонію оксалату додають 5-6 крапель 2М розчину сульфатної кислоти, нагрівають і додають краплями розведений розчин калію перманганату.
1.8. Реакції йонів CrO42- (Cr2O72-)
1.8.1. Дія солей Барію
Хромат- та дихромат-йони з розчином барію хлориду утворюють жовтий осад барію хромату:
СrO42- + Bа2+ → BаСrO4↓
Сr2O72- + 2Bа2+ + H2O → 2BаСrO4↓ + 2H+
Виконання досліду:
До 0,5-1 см3 розчину, що містить хромат- чи дихромат-йони, додають 5-6 крапель розчину барію хлориду.
1.8.2. Дія розчину калію йодиду
Дихромат-йони в кислому середовищі оксидують йодид-йони до вільного йоду, який забарвлює хлороформний шар у червоно-фіолетовий колір:
Сr2O72- + 14H+ + 6I- → 2Cr3+ + 3I2 + 7H2O.
Виконання досліду:
До 0,5 см3 розчину калію хромату або дихромату, підкисленого 1М розчином сульфатної кислоти, додають 15 крапель хлороформу і 5-7 крапель розчину калію йодиду. Зазначте аналітичний ефект реакції.
1.9. Реакції йонів PO43-
1.9.1. Дія магнезіальної суміші
Реагент (суміш MgCl2, NH4OH, NH4Cl) утворює з йонами PO43- білий дрібнокристалічний осад подвійної солі - магній-амоній-фосфату.
HPO42- + Mg2+ + NH3 → MgNH4PO4↓
Реакцію проводять у слаболужному середовищі, в присутності амонію хлориду. Осад розчинний в розчинах мінеральних кислот.
Виконання досліду:
До 0,5-2 см3 розчину, що містять йони PO43-, додають 1-2 краплі амонію гідроксиду, мікрошпатель амонію хлориду і 3-4 краплі розчину магнію хлориду.
Всі йони, що утворюють нерозчинні сполуки з йонами Mg2+ і PO43-, перешкоджають виявленню фосфат-йонів.
1.9.2. Дія молібденової рідини
Молібденова рідина (суміш амонію молібдату і нітратної кислоти) утворює з йонами PO43- дрібнокристалічний жовтий осад амонійної солі фосфат-молібденової гетерополікислоти. Реакцію проводять у присутності надлишку нітратної кислоти в розчині. Осад нерозчинний в HNO3, але розчинний в NaOH.
Na2HPO4 + 12(NH4)2MoO4 + 23HNO3 → 2NaNO3 + 21NH4NO3 +
(NH4)3PO4•12MoO3↓ + 12H2O
Виконання досліду:
До 1 см3 розчину, що містить йони PO43-, додають 5-6 см3 молібденової рідини і залишають на 5 хвилин. Виявленню РО43- перешкоджають йони AsO43- і SiO32-, утворюючи подібні за зовнішнім виглядом осади. Перешкоджаючий вплив цих йонів усувають додаванням тартратної кислоти.
1.9.3. Дія аргентуму нітрату
Аргентуму нітрат утворює з йонами PO43- жовтий осад, розчинний у розведеній нітратній кислоті та розчині аміаку:
PO43- + 3Ag+ → Ag3PO4↓
Ag3PO4↓ + 3H+ →3Ag+ + H3PO4
Ag3PO4↓ + 6NH3 →3[Ag(NH3)2]+ + PO43-
Виконання досліду:
До 1 см3 розчину, що містить йони PO43-, нейтралізованого до рН близько 7,0 додають декілька крапель розчину арґентуму нітрату. Утворюється жовтий осад.
1.10. Реакції йонів AsO33-
1.10.1. Дія розчинів сульфідів (фармакопейна)
Арсеніт-йони в кислому середовищі з сульфід-йонами утворюють жовтий осад As2S3:
2AsO33- + 6H+ + 3H2S → As2S3↓ + 6H2O
Виконання досліду:
До 0,5 см3 розчину, що містить арсеніт-йони, додають 3-4 краплі хлоридної кислоти і 5-6 крапель розчину сірководневої води.
1.10.2. Дія розчину йоду
Арсеніт-йони в слабколужному середовищі, яке створюють насиченим розчином натрію гідрокарбонату, знебарвлюють розчин йоду.
AsO33- + 2OH- + [I3]- → AsO43- + H2O + 3I-.
Виконання досліду:
До 4-5 крапель нейтралізованого ацетатною кислотою розчину натрію арсеніту додають 3-4 краплі насиченого розчину натрію гідрокарбонату і краплями розведений розчин йоду.
1.11. Реакції йонів AsO43-
1.11.1. Дія розчину аргентуму нітрату (фармакопейна)
Арсенат-йони утворюють з йонами Аргентуму коричневий осад аргентуму арсенату:
Na3AsO4 + 3AgNO3 → Ag3AsO4↓ + 3NaNO3
Виконання досліду:
До 0,5 см3 розчину, що містить натрію арсенат, додають 4-5 крапель розчину аргентуму нітрату.
1.11.2. Дія розчину калію йодиду
Арсенат-йони в середовищі концентрованої хлоридної кислоти оксидують йодид-йони до вільного йоду, який забарвлює хлороформний шар у червоно-фіолетовий колір.
AsO43- + 2H+ + 2I- → AsO33- + H2O + I2.
Виконання досліду:
До 0,5 см3 розчину натрію арсенату, підкисленого 4-5 краплями концентрованої хлоридної кислоти, додають 15 крапель хлороформу і 5-7 крапель розчину калію йодиду, добре струшують. Зазначте аналітичний ефект реакції.
1.12. Реакції йонів SiO32-
1.12.1. Дія розчинів солей Барію
Силікат-йони з солями Барію утворюють білий осад барію силікату:
SiO32- + Bа2+ → BаSiO3↓
Осад при дії кислот розкладається з утворенням желеподібного осаду змінного складу nSiO2•mH2O:
BaSiO3 + 2H+ → Bа2+ + H2SiO3↓
Виконання досліду:
До 0,5-1 см3 розчину, що містить силікат-йони, додають 5-6 крапель розчину барію хлориду.
1.12.2. Дія розчинів солей амонію
Силікат-йони при дії солей амонію утворюють білий желеподібний осад силікатної кислоти:
SiO32- +2H2O + 2NH4+ → H2SiO3↓ + 2NH4OH.
Виконання досліду:
До 0,5-1 см3 розчину, що містить силікат-йони, додають декілька кристалів амонію хлориду і нагрівають на водяній ванні.
1.13. Реакції йонів B4O72-
1.13.1. Дія розчинів солей Барію
Тетраборат-йони з солями Барію утворюють білий осад барію метаборату Ba(BO2)2:
B4O72- + Bа2+ + 3H2O → Ba(BO2)2↓ + 2H3BO3
Осад при дії мінеральних кислот розкладається:
Ba(BO2)2↓ + 2H2O + 2H+ → Bа2+ + 2H3BO3
Виконання досліду:
До 0,5-1 см3 розчину, що містить силікат-йони, додають 5-6 крапель розчину барію хлориду і 4-5 крапель 2М розчину натрію гідроксиду.
1.13.2. Забарвлення полум’я (фармакопейна)
(реакцію виконують сухим способом)
Тетраборат-йони в присутності сульфатної кислоти і етилового спирту утворюють борноетиловий етер, який забарвлює полум’я у зелений колір:
Na2B4O7 + H2SO4 + 5H2O → Na2SO4 + 4H3BO3
H3BO3 + 3C2H5OH → (C2H5O)3B + 3H2O
Виконання досліду:
У тигель поміщають декілька кристаликів натрію тетраборату, додають 5-6 крапель концентрованої сульфатної кислоти, 7-8 крапель етилового спирту, добре перемішують і запалюють. Зазначте аналітичний ефект реакції.
1.14. Реакції йонів F-
1.14.1. Дія розчинів солей Барію
Флуорид-йони з солями Барію утворюють білий осад барію флуориду BaF2:
2F- + Bа2+ → BaF2↓
Осад при дії мінеральних кислот розкладається:
BaF2↓ + 2H+ → Bа2+ + 2HF
Виконання досліду:
До 0,5-1 см3 розчину, що містить флуорид-йони, додають 5-6 крапель розчину барію хлориду.
1.14.2. Утворення силіцію флуориду
(реакцію виконують сухим способом)
При дії сульфатної кислоти на сухі флуориди утворюється HF, який реагує з склом пробірки з утворенням SiF4. Останній необоротно гідролізує, внаслідок чого випадає желеподібний осад H2SiO3:
CaF2 + H2SO4 → CаSO4↓ + 2HF
SiO2 + 4HF → SiF4↑ + 2H2O
SiF4 + 3H2O → H2SiO3↓ + 4HF
Виконання досліду:
Декілька кристалів кальцію флуориду і піску змішують з 3-5 краплями концентрованої сульфатної кислоти. Суміш вносять у суху пробірку і закривають корком з вставленою в нього металічною петлею, що містить краплю дистильованої води. Зазначте аналітичний ефект.
Завдання 2. Аналіз суміші сірковмісних аніонів (S2-, S2O32-, SO32-, SO42-).
Систематичний хід аналізу
2.1. Виявлення та відокремлення S2-
До окремої порції розчину, який досліджується, додають розчин натрію гідроксиду (до рН > 7) та натрію нітропрусиду. У присутності сульфід-аніонів утворюється комплексна сполука червоно-фіолетового кольору:
S2- + [Fe(CN)5NO]2- ↔ [Fe(CN)5NOS]4-
Із окремої порції розчину відокремлюють сульфід-йони дією розчину кадмію карбонату:
S2- + Cd2+ → CdS↓
Осад 1, де знаходится кадмію сульфід, відділяють центрифугуванням. У центрифугаті 1 – сульфат-, сульфіт-, тіосульфат-йони.
2.2. Відокремлення йонів S2O32-
До центрифугату 1 додають розчин солі стронцію. При цьому утворюється осад:
SO32- + Sr2+ → SrSO3↓
SO42- + Sr2+ → SrSO4↓
Осад відокремлюють центрифугуванням. У центрифугаті 2 залишаються тіосульфат-йони, в осаді 2 – сульфат- і сульфіт-йони.
2.3. Виявлення йонів SO32- і SO42-
До осаду 2 додають 2М розчин хлоридної кислоти:
SrSO32- + 2H+ → Sr2+ + SO2↑ + H2O
Неповне розчинення осаду свідчить про присутність сульфат-йонів через те, що SrSO4↓ не розчиняється в кислотах. Утворений осад 3 відокремлюють центрифугуванням і не аналізують.
Для виявлення сульфіт-йонів до центрифугату 3 додають розчин йоду. Якщо дані йони присутні, то розчин йоду знебарвлюється.
2.4. Виявлення йонів S2O32-
До окремої порції центрифугату 2 додають 2М розчину хлоридної кислоти. Утворення білої каламуті вказує на присутність тіосульфат-йонів у досліджуваному розчині:
S2O32- + 2H+ → H2S2O3 → SO2↑ + H2O + S↓
Для уточнення отриманих даних до центрифугату 2 додають розчин йоду і якщо забарвлення розчину зникає, то тіосульфат-йони присутні.
Завдання 3. Характерні реакції аніонів другої
аналітичної групи
Реакції виявлення аніонів другої аналітичної групи
(Cl-, I-, S2-, Br-)
3.1.Дія групового реагенту (розчин аргентуму нітрату)
Аргентуму нітрат утворює з йонами другої аналітичної групи осади відповідних солей. Всі реакції проводять в середовищі розбавленої нітратної кислоти.
Білий осад аргентуму хлориду нерозчинний у розбавлених кислотах, але розчиняється в розчинах амонію гідроксиду і амонію карбонату. Цю властивість використовують для відділення хлорид-йонів від бромід- і йодид-йонів. Слабо-жовтий осад аргентуму броміду нерозчинний у розбавлених кислотах і (NH4)2CO3, але розчинний в NH4OH. Ясно-жовтий осад аргентуму йодиду нерозчинний ні в одному із названих реагентів. Чорний осад аргентуму сульфіду не розчиняється в розчині амонію гідроксиду, але розчиняється при нагріванні в розведеній нітратній кислоті.
Виконання реакцій:
До 0,5-1 см3 розчинів, що містять аніони II-ї аналітичної групи, додають по 5-6 крапель розчину нітратної кислоти і по 3-4 краплі розчину аргентуму нітрату.
3.2. Реакції хлорид-йонів
3.2.1. Дія розчину аргентуму нітрату (фармакопейна)
Аргентуму нітрат в середовищі розбавленої нітратної кислоти утворює з хлорид-йонами білий осад аргентуму хлориду, який, на відміну від AgBr і AgI розчиняється в 10-12%-ному розчині амонію карбонату. Цю властивість, як уже вказувалося вище, використовують для відділення осаду AgCl від осадів AgBr і AgI та наступного його виявлення:
Ag+ + Cl- → AgCl↓
Виконання досліду:
До 0,5-1 см3 розчину, що містить хлорид-йони, додають 10-12 крапель нітратної кислоти і 5-6 крапель розчину аргентуму нітрату.
3.2.2. Дія оксидників
Оксидники (MnO2, KMnO4, K2Cr2O7) в кислому середовищі оксидують хлорид-йони до вільного хлору:
MnO2 + 2NaCl + 2H2SO4 → Na2SO4 + MnSO4 + 2H2O + Cl2↑
Виконання досліду:
Помістити в пробірку мікрошпатель мангану діоксиду, долити 1-2 см3 розчину натрію хлориду і стільки ж концентрованої сульфатної кислоти. Суміш обережно нагріти. Хлор, що виділяється, виявляють за запахом або за посинінням йодокрохмального паперу.
3.3. Реакції бромід-йонів
3.3.1. Дія розчину аргентуму нітрату (фармакопейна)
Аргентуму нітрат утворює з бромід-йонами блідо-жовтий осад аргентуму броміду. Осад не розчиняється в нітратній кислоті, погано розчиняється в амонію гідроксиді і добре розчиняється в розчині натрію тіосульфату.
Ag+ + Br- → AgBr↓
Виконання досліду:
До 0,5-1 см3 розчину, що містить бромід-йони, додають 5-6 крапель розчину аргентуму нітрату.
3.3.2. Дія оксидників (фармакопейна)
Оксидники (MnO2, KMnO4, хлорна вода) оксидують бромід-йони до вільного брому:
2KBr + Cl2 → 2KCl + Br2↑
Виконання досліду:
До 2-3 крапель розчину калію броміду додають 2-3 краплі 1М розчину сульфатної кислоти, 5-7 крапель хлороформу і приливають краплями при постійному струшуванні свіжовиготовлену хлорну воду. При цьому органічний розчинник забарвлюється в лимонно-жовтий колір.
3.3.3. Дія розчину хлораміну
Хлорамін в присутності розведеної хлоридної кислоти оксидує бромід-йони до вільного брому:
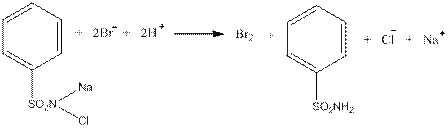
Виконання досліду:
До 1 см3 розчину броміду додають 2 см3 розведеної хлоридної кислоти, 0,5 см3 хлораміну та 1 см3 хлороформу. Збовтують. Хлороформний шар забарвлюється в жовто-бурий колір.
3.3.4. Дія розчину купруму сульфату
Розчин купрум сульфату в сильнокислому середовищі утворює чорний осад купрум броміду:
Cu2+ + 2Br- → CuBr2↓
Виконання досліду:
До 1-2 крапель розчину калію броміду додають 1 краплю купруму сульфату, 5 крапель концентрованої сульфатної кислоти. З’являється чорний осад. Після додавання декількох крапель води відбувається знебарвлення.
3.4. Реакції йодид-йонів
3.4.1. Дія розчину аргентуму нітрату
Аргентуму нітрат утворює з йодид-йонами жовтий осад аргентуму йодиду. Осад не розчиняється в нітратній кислоті і амонію гідроксиді, погано розчиняється в розчині натрію тіосульфату.
Ag+ + I- → AgI↓
Виконання досліду:
До 0,5-1 см3 розчину, що містить йодид-йони, додають 5-6 крапель розчину аргентуму нітрату.
3.4.2. Дія нітритів
Калію нітрит або натрію нітрит в кислому середовищі оксидують йодид-йони до вільного йоду:
2KI + 2KNO2 + 2H2SO4 → 2K2SO4 + I2↑ + 2NO + 2H2O
Виконання досліду:
До 2-3 крапель розчину калію йодиду додають 2-3 краплі 1М розчину сульфатної кислоти, 5-7 крапель хлороформу і 3-4 краплі калію нітриту. При цьому органічний розчинник забарвлюється в синій колір.
3.4.3. Дія сульфатної кислоти
При нагріванні 0,1 г йодиду з 1 см3 концентрованої сульфатної кислоти виділяються фіолетові пари йоду.
3.5. Реакції сульфід-йонів
3.5.1. Дія розчину аргентуму нітрату
Аргентуму нітрат утворює з сульфід-йонами чорний осад аргентуму сульфіду. Осад не розчиняється в амонію гідроксиді, але розчиняється в розчині розбавленої нітратної кислоти.
2Ag+ + S2- → Ag2S↓
Виконання досліду:
До 0,5-1 см3 розчину, що містить сульфід-йони, додають 5-6 крапель розчину аргентуму нітрату.
3.5.2. Дія солей кадмію
Солі кадмію з сульфід-йонами утворюють жовтий осад кадмію сульфіду:
Cd2+ + S2- → CdS↓
Виконання досліду:
До 2-3 крапель розчину амонію сульфіду додають стільки ж розчину кадмію хлориду.
3.5.3. Дія натрію нітропрусиду
Сульфід-йони з натрію нітропрусидом при рН > 7 утворюють комплексну сполуку червоно-фіолетового кольору:
S2- + [Fe(CN)5NO]2- → [Fe(CN)5NOS]4-
Виконання досліду:
До 2-3 крапель розчину амонію сульфіду додають стільки ж розчину натрію нітропрусиду.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 954; Нарушение авторских прав?; Мы поможем в написании вашей работы!