
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретичні відомості
|
|
|
|
ВИЗНАЧЕННЯ ВІДНОШЕННЯ ТЕПЛОЄМНОСТЕЙ ПОВІТРЯ МЕТОДОМ АДІАБАТИЧНОГО РОЗШИРЕННЯ
Лабораторна робота № 162
Контрольні питання
1. Який газ називають ідеальним? Навести приклади такого газу.
2. Записати рівняння Клапейрона - Менделєєва та основне рівняння молекулярно - кінетичної теорії ідеального газу.
3. Пояснити фізичний зміст сталих R, k,NA.
4. Записати рівняння Майєра і пояснити фізичний зміст величин.
5. Дати визначення густини та концентрації; знайти формули для обчислення густини ідеального газу та концентрації його молекул.
Мета роботи: на досліді визначити відношення Cp/CV для повітря.
Прилади та обладнання: прилад для визначення Cp/CV повітря, ручний нагнітальний насос.
Відношення питомих або молярних теплоємностей γ = Cp/CV відіграє велику роль в адіабатичних процесах або в процесах, близьких до них. За значенням γ = Cp/CV визначають швидкість розповсюдження звуку в газах, від нього залежить течія газів по трубах зі звуковими швидкостями і досягнення надзвукових швидкостей в трубах, що розширюються.
Адіабатичним називають процес, який проходить без теплообміну із зовнішнім середовищем. Залежність між параметрами газу в адіабатичному процесі визначають за рівнянням Пуассона:
pVγ = const
де p, V- відповідно тиск та об'єм газу; γ- коефіцієнт Пуассона (показник адіабати), який дорівнює відношенню питомої (молярної) теплоємності при сталому тиску до питомої (молярної) теплоємності при сталому об’ємі, тобто
γ = Cp/CV.
Питома теплоємність - це величина, яка дорівнює кількості теплоти δQ, необхідної для нагрівання одиниці маси речовини на 1 К:
с = δQ/(mdT).
Молярна теплоємність речовини – величина, яка дорівнює кількості теплоти δQ, необхідної для нагрівання 1 моля речовинина 1 К:
C = 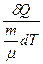
Молярна (С) та питома (с) теплоємності пов’язані між собою співвідношенням
C = μс.
Теплоємність газу залежить від умов його нагрівання. Для нагрівання однієї і тієї ж маси газу до однакової температури при ізобаричному процесі треба витратити більше теплоти, ніж при ізохоричному, бо при ізобаричному процесі, крім витрати теплоти на зміну внутрішньої енергії (збільшення температури), теплота витрачається і на зовнішню механічну роботу (чого нема при ізохоричному процесі). Тому молярна теплоємність ідеального газу при сталому тиску Cp більша за його молярну теплоємність при сталому об’ємі CV на універсальну газову сталу:
Cp= CV+ R.
Це співвідношення називають рівнянням Майєра. Його можна вивести з I закону термодинаміки: кількість теплоти δQ, яку одержує система, витрачається на зміну її внутрішньої енергії dU та на виконання роботи δA проти зовнішніх сил:
δQ = dU + δA. (162.1)
При ізобаричному процесі δA = pdV = 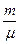 RdT (162.2)
RdT (162.2)
тоді δQр = 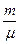 CpdT. 162.3)
CpdT. 162.3)
Якщо газ нагрівають при сталому об’ємі, то δА= 0, і тоді згідно I закону термодинаміки:
dQV = CV 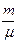 dT= dU (162.4)
dT= dU (162.4)
Підставимо формули (162.2) - (162.4) в (162.1) і одержимо рівняння Майєра. Згідно з класичною молекулярно-кінетичною теорією молярна теплоємність при сталому об'ємі CV= 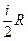 ,
,
а молярна теплоємність при сталому тиску С 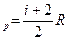 ,
,
де і - число ступенів вільності молекули (кількість незалежних координат, які визначають положення молекули у просторі). Для одноатомних молекул газу
і = 3; для двохатомних і = 5; для трьох– і більше атомних і = 6.
Тоді показник адіабати ідеального газу
γ = Cp/CV = 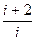 . (162.5)
. (162.5)
За формулою (162.5) можна теоретично визначити показник адіабати, якщо повітря прийняти за двохатомний газ.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 3780; Нарушение авторских прав?; Мы поможем в написании вашей работы!