
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фізичні та хімічні властивості алкенів
|
|
|
|
Фізичні властивості. Як і в гомологічному ряді насичених вуглеводнів, нижчі представники алкенів є, при звичайній температурі, газами: починаючи з алкенів (С5Н10) – рідини, вищі гомологи, починаючи з С19Н38 – тверді тіла. Розчинність нижчих гомологів у воді невелика й зменшується зі зростанням молекулярної маси; точки кипіння і молекулярні маси алкенів вищі, ніж у насичених вуглеводнів з таким же карбоновим скелетом.
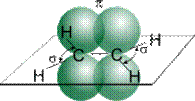
Хімічні властивості. Карбонові атоми в молекулі етилену перебувають у стані sp2- гібридизації, тобто в гібридизації беруть участь одна s- і дві p-орбіталі.

| 
|
| Рис. 1. Схематичне зображення будови молекули етилену. |
У результаті кожний атом Карбону володіє трьома гібридними sp2-орбіталями, осі яких перебувають в одній площині під кутом 120º одна до одної, і однієї негібридної гантелеподібної p-орбіталі, вісь якої розташована під прямим кутом до площини осей трьох sp2-орбіталей. Одна із трьох гібридних орбіталей атома Карбону перекривається з подібною орбіталлю іншого атома Карбону, утворюючи -зв'язок. Кожна, з інших вільних гібридних орбіталей атомів Карбону перекривається з s-орбіталлю атомів Гідрогену, що призводить до утворення в тій же площині чотирьох -зв'язків C–H. Дві негібридні p-орбіталі атомів Карбону взаємно перекриваються й утворюють -зв'язок, максимальна густина якого розташована перпендикулярно площини - зв'язків. Отже, подвійний зв'язок алкенів являє собою сполучення - і - зв'язків.
p-Зв'язок менш міцний, ніж s-зв'язок, тому що p-орбіталі з паралельними осями перекриваються значно менше, ніж при утворенні тими ж p-орбіталями й s-орбіталями s- зв'язку (перекривання здійснюється по осі орбіталей). У зв'язку із цим, p-зв'язок легко розривається й переходить у два нові s-зв'язки за допомогою приєднання по місцю подвійного зв'язку двох атомів або груп атомів реагуючих речовин. Іншими словами, для алкенів найбільш типовими є реакції приєднання. У реакціях приєднання подвійний зв'язок виступає як донор електронів, тому для алкенів характерні реакції електрофільного приєднання.
1. Приєднання гідрогену (гідрування). Алкени в присутності металічних каталізаторів (платини, паладію, нікелю, міді) приєднують гідроген, утворюючи насичені вуглеводні. Так, у присутності подрібненої платини або паладію алкени вже при звичайній температурі приєднують гідроген (С.О. Фокін, Р. Вільштеттер):
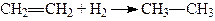 .
.
За наявності подрібненого нікелю ця реакція проходить при температурі 150 – 300°C (реакція Сабатьє).
Каталізатори застосовують у дрібноподрібненому стані. Іноді каталізатори наносять на носій – азбест, активоване вугілля, кізельгур, пемзу, каолін, кальцій карбонат.
2. Приєднання галогенів. Алкени дуже легко приєднують галогени, особливо хлор і бром:
 ,
,
 .
.
Реакцією приєднання брому (бромної води) користуються для відкриття в молекулі подвійних зв’язків. Ознакою наявності подвійного або потрійного зв’язку є знебарвлення бромної води.
Реакцію приєднання брому до алкенів використовують також для кількісного визначення подвійного зв’язку, при цьому титрування провадять до зникнення забарвлення брому. Як розчинники можна застосувати хлороформ, чотирихлористий вуглець, сірковуглець, оцтову (льодяну) кислоту та ефіри.
3. Приєднання галогеноводнів. Алкени легко приєднують за місцем подвійного зв’язку галогеноводні, причому найбільш легко приєднують HJ, найбільш важко – НСl
 .
.
При цьому атом гідрогену приєднується до найбільш гідрогенізованого карбонового атома, тобто карбону, зв’язаного з найбільшою кількістю атомів гідрогену. Ця закономірність була встановлена В.В. Марковниковим і тому називається правилом Марковникова.
Виходячи з сучасних електронних уявлень, правило В.В. Марковникова можна пояснити так. В етилені та в симетрично побудованих його похідних, де Карбонові атоми, сполучені подвійним зв’язком, цілком рівноцінні, електронна густина розподілена рівномірно (симетрично), внаслідок цього молекули їх неполярні. У пропілені, як несиметричному алкені, симетричний розподіл електронної густини порушено. Тут під впливом метильної групи електронна хмара подвійного зв’язку зміщена в напрямку до метиленової групи, що приводить до виникнення полярності всієї молекули та виявляється в наявності дипольного моменту. Розподіл електронної густини має вигляд:

Тому атом Карбону 3 стає до певної міри зарядженим негативно, а атом карбону 2 – позитивно. Заряд атома карбону 2 трохи зменшений завдяки індукційному впливу метильної групи, але залишається позитивним
 .
.
Такий розподіл зарядів і обумовлює спрямування реакцій пропілену. Природно, що катіон приєднуючого агента повинен приєднуватися за місцем найбільшої електронної густини, тобто до найбільш гідрогенізованого атома карбону; поляризація молекули пропілену особливо підсилюється в момент реакцій, наприклад:
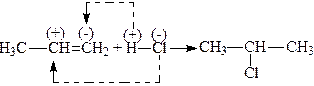 .
.
У деяких випадках приєднання Алкени, алкіни належать до ненасичених органічних сполук. Ненасиченими називаються сполуки, молекули яких містять атоми вуглецю, сполучені подвійними і потрійними зв`язками.
У деяких випадках приєднання відбувається в зворотному напрямку. Так, Караш встановив, що за наявності оксигену повітря, перекисних сполук або інших джерел вільних радикалів, приєднання HBr до несиметрично побудованих гомологів етилену відбувається всупереч цьому правилу і гідроген приєднується до найменш гідрогенізованих атомів карбону (пероксидний ефект Караша):
 .
.
4. Приєднання елементів води (гідратація алкенів). Приєднання елементів води до алкенів призводить до утворення вторинних або третинних спиртів, і лише етилен утворює первинний (етиловий) спирт:
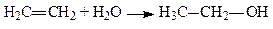 ,
,
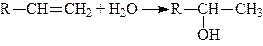 ,
,
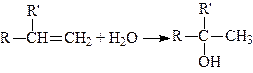 .
.
Приєднання елементів води відбувається за правилом Mapковникова: гідроген приєднується до найбільш гідрогенізованого атома карбону, а гідроксил – до найменш гідрогенізованого.
У заводській практиці приєднання елементів води до алкенів здійснюють шляхом прямої і непрямої гідратації.
Метод прямої гідратації полягає в безпосередній взаємодії алкену з водою або водяною парою за наявності каталізаторів (фосфорна кислота та її солі, сульфатна кислота, оксид алюмінію та ін.).
Встановлено, що гідратація ізоалкенів відбувається легше, ніж алкенів нормальної будови. Чим коротший карбоновий ланцюг вуглеводню, тим важче відбувається гідратація; найважче гідратується етилен.
При одержанні спиртів за методом непрямої гідратації спочатку відбувається приєднання до алкенів сульфатної кислоти з утворенням суміші кислих та середніх сульфатнокислих ефірів (алкілсульфатних кислот та діалкілсульфатів). Швидкість процесу залежить від будови вуглеводню, умов проходження (тиск, температура) і концентрації сульфатної кислоти.
Швидкість взаємодії алкенів з сульфатною кислотою зростає при переході до вищих гомологів – до С6, а далі (починаючи з С7) зменшується. Ізоалкени взаємодіють, як правило, значно швидше, ніж олефіни нормальної будови.
5. Приєднання гіпохлоритної кислоти. Алкени легко приєднують за місцем подвійного зв’язку гіпохлоритну кислоту; при цьому до одного Карбонового атома (більш гідрогенізованого) приєднується хлор до іншого – гідроксил:
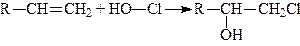 .
.
6. Приєднання алканів (алкілування). Алкени приєднують алкани, наприклад, при взаємодії n -бутилену з ізобутаном утворюється 2, 2, 3-триметилпентан:
 .
.
Процес алкілування може відбуватися як за наявності каталізаторів (H2SO4, HF, АlСl3 та ін.), так і без них.
Каталітичний процес провадять при нормальній температурі і під тиском, близьким до атмосферного. В присутності 96 – 97%-ної сульфатної кислоти алкани, які мають третинний Карбоновий атом, легко реагують з алкенами (крім етилену). Більш активним каталізатором є хлористий алюміній у присутності якого можна алкілувати етиленом ізоалкани та алкани нормальної будови. За відсутності каталізаторів алкілування насичених вуглеводнів проводять під тиском 300 – 350 ат. і при температурі близько 500°С.
Реакція алкілування алканів алкенами застосовується в техніці головним чином для одержання компонентів моторного палива з високими антидетонаційними властивостями.
7. Окиснення алкенів. На відміну від алканів алкени легко піддаються окисненню. При обережному окисненні їх водним розчином КМnО4 в лужному середовищі (на холоді), як вперше встановив російський хімік Є.Є. Вагнер, за місцем подвійного зв’язку відбувається приєднання атома Оксигену і молекули води і утворюються двоатомні спирти, або гліколі, наприклад:
 .
.
Ця реакція є якісною реакцією на алкени. Фіолетове забарвлення розчину КМnO4 знебарвлюється (МnO4- переходить в Мn+2), а потім буріє від виділення осаду – марганець двооксиду МnО2.
За наявності срібла як каталізатора при температурі 150 – 350°С нижчі алкени окислюються киснем повітря, утворюючи оксиди алкенів, наприклад:
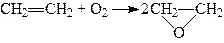 .
.
При більш значному окисленні алкенів ланцюг атомів карбону розривається за місцем подвійного зв’язку і утворюються дві молекули оксигеновмісних речовин з меншою кількістю карбонових атомів у кожному.
8. Озонування алкенів. Озон легко приєднується до молекули етиленового вуглеводню з утворенням озонідів:
 .
.
Метод озонування був запропонований німецьким хіміком Г. Гаррісом. Озоніди – дуже вибухонебезпечні речовини, при нагріванні з водою розпадаються, утворюючи перекис гідрогену і альдегіди або кетони. За будовою одержаних при озонуванні альдегідів і кетонів можна судити про будову алкенів.
9. Оксосинтез. Оксосинтезом, або гідроформілуванням, називають каталітичну реакцію приєднання до алкенів карбон монооксиду і гідрогену (СО + Н2, водяний газ), у результаті якої утворюються переважно альдегіди. Реакцію провадять під тиском при нагріванні, наявності карбонілів кобальту або нікелю (метод Репне):
 .
.
10. Полімеризація алкенів. Молекули одного й того ж алкену за певних умов можуть сполучатися один з одним. Хімічний процес сполучення кількох однакових або різних молекул низькомолекулярних речовин (мономерів) з утворенням речовини більшої молекулярної маси, яка має такий же елементарний склад, як і вихідний мономер, називається реакцією полімеризації:
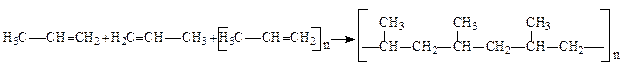
Коли полімеризуються молекули однієї якої-небудь речовини, реакція називається гомополімеризацією. При полімеризації двох або більшої кількості різних речовин реакція має назву сумісної полімеризації, або співполімеризації.
Здатність сполук до полімеризації обумовлена наявністю в них кратних зв’язків, або ж циклів, схильних до розмикання. При сполученні двох молекул продукт полімеризації називається димером, трьох молекул – тримером, при сполученні багатьох молекул – полімером.
Рівняння реакції полімеризації в найбільш загальному вигляді може бути подано так:
nA ® (A)n,
де А – молекула мономеру, Аn – кількість з’єднаних молекул мономеру, тобто ступінь полімеризації або коефіцієнт полімеризації залежить від природи речовини і від умов полімеризації.
За механізмом реакції розрізняють східчасту та ланцюгову полімеризації.
Східчаста полімеризація виникає в результаті відщеплення атома гідрогену або яких-небудь груп атомів від одної молекули і переходу їх до іншої молекули, що може привести до звільнення зв’язків в обох молекулах і з’єднанню їх один з одним. За східчастим механізмом відбувається полімеризація алкенів при високій температурі в присутності сульфатної кислоти, полімеризація формальдегіду, а також полімеризація таких сполук, як оксид етилену, 2-капролактану та ін.
Східчаста полімеризація в більшості випадків призводить до утворення порівняно низькомолекулярних полімерів.
Найбільше значення для добування високомолекулярних сполук має ланцюгова реакція полімеризації, при якій відбувається безперервне приєднання молекул мономеру до активного кінця ростучої молекули.
Уявлення про ланцюгові реакції полімеризації основані на загальній теорії ланцюгових реакцій М.М. Семенова. Цей вид полімеризації характеризується тим, що енергія після протікання одного акту приєднання не розсіюється в оточуюче середовище, а передається іншій молекулі і збуджує новий акт приєднання.
Ланцюговий процес полімеризації в загальному вигляді може бути показано за трьома етапами: 1) початок росту ланцюга (утворення активних центрів); 2) ріст ланцюга; 3) обрив ланцюга.
Для росту ланцюга необхідно активувати молекули мономерів. Використовують для цього ініціатор, каталізатор або фізичні методи впливу (світло, тепло і т.п.).
Ініціаторами полімеризації виступають нестійкі сполуки (перекиси), здатні розпадатися з виділенням вільних радикалів, які мають неспарений електрон.
Утворений вільний радикал реагує з молекулою мономеру, внаслідок чого утворюється новий вільний радикал з неспареним електроном.
Ріст ланцюга відбувається в результаті багаторазового повторення реакції приєднання мономеру до кінця ростучої молекули. Третій етап ланцюгової реакції – обрив ланцюга – здійснюється внаслідок насичення вільних валентностей радикалів. Полімеризаційні процеси лежать в основі виробництва таких важливих для народного господарства продуктів, як синтетичні каучуки, синтетичні волокна, мастила і т.п.
10. Ізомеризація. Під впливом різних каталізаторів (кислоти, хлористий цинк та ін.), особливо при нагріванні, часто відбувається процес ізомеризації вуглеводнів, який полягає в зміні будови молекули вуглеводню без зміни його молекулярної маси та складу. При ізомеризації може змінюватися положення подвійних зв’язків між карбоновими атомами, можуть утворюватися бокові ланцюги, відбуватися циклізація або розрив циклу. Як приклад, можна навести ізомеризацію n -бутилену в ізобутилен:

n -пентилену в циклопентан
 .
.
Застосування алкенів. Алкени широко використовуються в промисловості як вихідні речовини для одержання розчинників (спирти, дихлоретан, ефіри, гліколі та ін.), полімерів (поліетилен, полівінілхлорид, поліізобутилен і ін.), а також багатьох інших найважливіших продуктів.
Етилен, пропілен та ізобутилен широко використовуються в промисловому органічному синтезі:
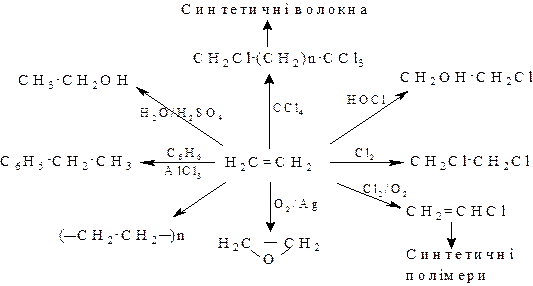

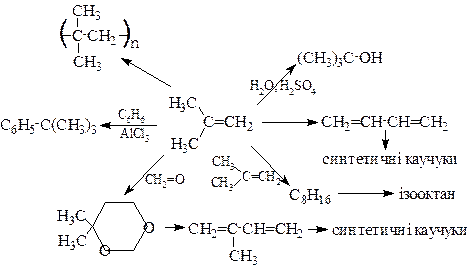
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 10627; Нарушение авторских прав?; Мы поможем в написании вашей работы!