
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение дисперсных систем
|
|
|
|
Известны два способа получения дисперсных систем. В одном из них тонко измельчают (диспергируют) твердые и жидкие вещества в соответствующей дисперсионной среде, в другом вызывают образование частиц дисперсионной фазы из отдельных молекул или ионов.
Методы получения дисперсных систем измельчением более крупных частиц называют диспергационными. Методы, основанные на образовании частиц в результате кристаллизации или конденсации, называют конденсационными.
23) Свойства каллоидов.
I тип - суспензоиды (или необратимые коллоиды, лиофобные коллоиды). Коллоидные растворы металлов, их оксидов, гидроксидов, солей. Первичные частицы дисперсной фазы не отличаются от структуры соответствующего вещества, имеют молекулярную или ионную решетку. Это высокодисперсные системы, с развитой межфазной поверхностью. От суспензий они отличаются дисперсностью. Их назвали так потому, что, они не могут длительно существовать без стабилизатора
II тип – ассоциативные (мицеллярные коллоиды) - полуколлоиды. Частицы этого типа возникают при достаточной концентрации дифильных молекул низкомолекулярных веществ в агрегаты молекул – мицеллы. Мицеллы - скопления правильно расположенных молекул, удерживаемых дисперсионными силами. Образование мицелл характерно для водных растворов моющих веществ и некоторых органических красителей. В других средах, эти вещества растворяются с образованием молекулярных растворов.
III тип - молекулярные коллоиды -лиофильными (греч «филио»- люблю). К ним относятся природные и синтетические высокомолекулярные вещества с молекулярной массой от десяти тысяч до нескольких миллионов. Молекулы этих веществ имеют размеры коллоидных частиц, поэтому такие молекулы называют макромолекулами.
Главная особенность коллоидных частиц - их малый размер d:1 нм < d < 10мкм
1) Диализ. Простейшим прибором для диализа - диализатором - является мешочек из полупроницаемого материала (коллодия), в который помещается диализируемая жидкость. Мешочек опускается в сосуд с растворителем (водой). Периодически или постоянно меняя растворитель в диализаторе можно практически полностью удалить из коллоидного раствора примеси электролитов и низкомолекулярных неэлектролитов.
^ 2) Электродиализ - процесс диализа, ускоряемый действием электрического тока. Электродиализ применяют для очистки коллоидных растворов, загрязненных электролитами. Если необходима очистки коллоидных растворов от низкомолекулярных неэлектролитов, процесс электродиализа малоэффективен. Процесс электродиализа мало отличается от обычного диализа.
^ 3) Ультрафильтрация - фильтрование коллоидных растворов через полупроницаемую мембрану, пропускающую дисперсионную среду с
низкомолекулярными примесями и задерживающую частицы дисперсной фазы или макромолекулы. Для ускорения процесса ультрафильтрации ее проводят при перепаде давления по обе стороны мембраны: под вакуумом или
повышенным давлением.
Ультрафильтрация есть не что иное, как диализ, проводимый под давлением
. 24) Гидрофобные коллоидно-дисперсные системы.
Гидрофобные коллоиды
дисперсные системы, в которых диспергированное вещество не взаимодействует с дисперсной средой (водой). См. Гидрофильность и гидрофобность.
Дисперсные системы, образования из двух или большего числа фаз (тел) с сильно развитой поверхностью раздела между ними. В Д. с. по крайней мере одна из фаз — дисперсная фаза — распределена в виде мелких частиц (кристалликов, нитей, плёнок или пластинок, капель, пузырьков) в другой, сплошной, фазе — дисперсионной среде. Д. с. по основной характеристике — размерам частиц или (что то же самое) дисперсности (определяемой отношением общей площади межфазной поверхности к объёму дисперсной фазы) — делятся на грубо (низко) дисперсные и тонко (высоко) дисперсные, или коллоидные системы (коллоиды). В грубодисперсных системах частицы имеют размер от 10-4 см и выше, в коллоидных — от 10-4—10-5 до 10-7 см.
25) Электрофорез и электроосмос.
Электроосмос
Направленное перемещение жидкости в пористом теле под действием приложенной разности потенциалов называется электроосмосом. Рассмотрим, например, электроосмотическое скольжение электролита в капилляре или порах мембраны. Примем для определенности, что на поверхности адсорбированы отрицательные ионы, которые закреплены неподвижно, а положительные ионы формируют диффузную часть ДЭС. Внешнее поле Е направлено вдоль поверхности. Электростатическая сила, действующая на любой произвольный элемент диффузной части ДЭС, вызывает движение этого элемента вдоль поверхности. Поскольку плотность заряда в диффузной части ДЭС Ф(х) меняется в зависимости от расстояния до поверхности х (рис. 1), разложенные слои жидкого электролита движутся с разными скоростями. Стационарное состояние (неизменность во времени скорости течения) будет достигнуто, когда действующая на произвольный слой жидкости электростатическая сила скомпенсируется силами вязкого сопротивления, возникающими из-за различия скоростей движения слоев жидкости, находящихся на разном удалении от поверхности. Уравнения гидродинамики, описывающие движение жидкости при постоянных вязкости жидкости и ее диэлектрической проницаемости м. б. решены точно, результатом решения является распределение скорости течения:
Здесь- значение электрического потенциала на расстоянии от поверхности, где скорость течения жидкости обращается в нуль (т. наз. плоскость скольжения).
Электрофорез
Направленное перемещение частиц дисперсной фазы под действием приложенной разности потенциалов называется электрофорезом.
Электрофоретическое движение частиц в электролите имеет родственную электроосмосу природу: внешнее электрическое поле увлекает ионы подвижной части ДЭС, заставляя слои жидкости, граничащие с частицами, перемещаться относительно поверхности частиц. Однако в силу массивности объема жидкости и малости взвешенных частиц эти перемещения сводятся в отсутствие внешних сил к движению частицы в покоящейся жидкости. Для непроводящих частиц с плоской поверхностью в системах с тонкой диффузной частью ДЭС скорость электрофореза совпадает со скоростью электроосмотического скольжения, взятой с обратным знаком. Для проводящих сферических частиц скорость электрофореза м. б. рассчитана по уравнению:
где- удельная электрическая проводимость частицы.
26) Строение мицелл золей.
Строение коллоидной мицеллы
Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения степени дисперсности дисперсной фазы (т.е. объединение частиц в более крупные агрегаты) – коагуляцию золей. Тем не менее золям присуща способность сохранять степень дисперсности – агрегативная устойчивость, которая обусловлена, во-первых, снижением поверхностной энергии системы благодаря наличию на поверхности частиц дисперсной фазы двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания частиц дисперсной фазы, имеющих одноименный электрический заряд.
AgNO3 + KI ––> AgI + KNO3

27) Коагуляция гидрофобных золей.
Гидрофобные дисперсные системы характеризуются кинетической агрегативной устойчивостью, определяемой скоростью процесса коагуляции. Кинетика коагуляции определяется уравнением Смолуховского:
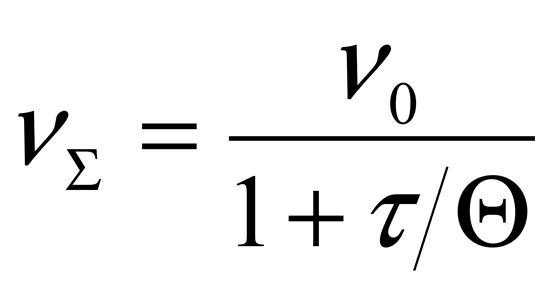
где - суммарное число частиц дисперсной фазы ко времени τ;
- первоначальное число частиц; - время половинной коагуляции; ^ К – константа скорости коагуляции.
28) Высокомолекулярные соединения. Строение. Растворение и набухания
Растворы высокомолекулярных соединений (вмс)
Высокомолекулярными соединениями называются вещества, имеющие молекулярную массу от 10000 до нескольких миллионов а.е.м.
Размеры молекул ВМС в вытянутом состоянии могут достигать 1000 нм, т.е. соизмеримы с размерами частиц в коллоидных растворах и микрогетерогенных системах.
Температура кипения ВМС значительно выше температуры разложения, поэтому они существуют, как правило, только в жидком или твердом состоянии
Макромолекулы ВМС представляют собой гигантские образования, состоящие из сотен и тысяч атомов, химически связанных между собой.
Все ВМС по происхождению можно разделить на природные, образующиеся при биохимическом синтезе, и синтетические, получаемые искусственно путем полимеризации или поликонденсации.
В зависимости от строения полимерной цепи ВМС делятся на линейные, разветвленные и пространственные.
Подобно истинным растворам низкомолекулярных веществ растворы ВМС образуются самопроизвольно и являются термодинамически устойчивыми. В этом состоит их отличие от лиофобных коллоидных систем. Термодинамическая устойчивость обусловлена благоприятным соотношением энтальпийного и энтропийного факторов.
ВМС обладают рядом свойств, характерных для дисперсных систем: они способны образовывать ассоциаты, размер которых соизмерим с размерами частиц золей (1-100 нм), рассеивают свет, способствуют образованию эмульсий, суспензий и пен, для них характерны диффузия и броуновское движение. В то же время, в отличие от лиофобных золей в растворах ВМС отсутствует гетерогенность, т.е. нет большой межфазной поверхности.
Специфическим свойством, присущим только ВМС, является набухание при взаимодействии с растворителем. Набухание может быть ограниченным и неограниченным. Последнее приводит к растворению полимера.
Существует большое количество ВМС, которые в растворе диссоциируют с образованием высокомолекулярных ионов, они называются полиадектролитами. В зависимости от природы полимерных групп полиэлектролиты могут быть катионными, анионными и амфотерными. Последние содержат в своем составе одновременно кислотные и основные группы. В зависимости от рН среды они диссоциируют как кислоты или как основания. Состояние, при котором положительные и отрицательные заряды в молекуле белка скомпенсированы, называется изоэлектрическим, а значение рН, при котором молекула переходит в изоэлектрическое состояние, называется изо - электрической точкой белка (ИТБ).
29) Студни.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2696; Нарушение авторских прав?; Мы поможем в написании вашей работы!