
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод кислотно-основного титрования 2 страница
|
|
|
|
А. Половине молярной массы.*
В. Молярной массе.
С. И то, и другое.
Д. Ни то, ни другое.
75. Укажите не применяемый в количественном анализе способ выражения концентрации титрантов:
1.Молярность.
2. Титр.
3. Титр по определяемому веществу.
4. Процентная.
5. Молярная масса эквивалента.
76. Точку конца титрования в методе кислотно-основного титрования определяют при помощи рН-индикаторов. При подборе рН индикаторов учитывают:
А. рН среды в точке эквивалентности.*
В. Природу титранта.
С. Свойства продуктов реакции.
Д. Изменение рН в процессе титрования.
Е. Природу анализируемого вещества.
77. Укажите характер кривой титрования при титровании раствора борной кислоты, H3BO3 (Kа1 = 7,1•10-10, Kа2 = 1,8•10-13, Kа3 = 1,6•10-14) 0,1 М раствором щелочи.
А. Скачок на кривой титрования отсутствует.*
В. Скачок на кривой титрования большой.
С. На кривой титрования четко выражены два скачка.
Д. На кривой титрования два скачка, второй скачок очень мал.
Е. На кривой титрования два скачка, но первый скачок мал.
78. Укажите характер кривой титрования при титровании раствора дихлоруксусной кислоты, (СI2CHCOOH, Kа1 = 5•10-2) 0,1 М раствором щелочи.
А. Скачок на кривой титрования большой.*
В. Скачок на кривой титрования отсутствует.
С. На кривой титрования четко выражены два скачка.
Д. На кривой титрования два скачка, второй скачок очень мал.
Е. На кривой титрования два скачка, но первый скачок мал.
79. Укажите характер кривой титрования при титровании раствора щавелевой кислоты, H2C2O4 (Kа1 = 5,6•10-2, Kа2 = 5,4•10-5) 0,1 М раствором щелочи.
А. На кривой титрования два скачка, но первый скачок мал.*
В. Скачок на кривой титрования отсутствует.
С. На кривой титрования четко выражены два скачка.
Д. На кривой титрования два скачка, второй скачок очень мал.
|
|
|
Е. Скачок на кривой титрования большой.
80. Укажите характер кривой титрования при титровании раствора сернистой кислоты, H2SO3 (Kа1 = 1,4•10-2, Kа2 = 6,2•10-8) 0,1 М раствором щелочи.
А. На кривой титрования два скачка, второй скачок очень мал.*
В. Скачок на кривой титрования отсутствует.
С. На кривой титрования четко выражены два скачка.
Д. Скачок на кривой титрования большой.
Е. На кривой титрования два скачка, но первый скачок мал.
81. Возможность титрования вещества по методу кислотно-основного титрования определяется:
А. Величиной кислотной или основной константы ионизации анализируемого вещества.*
В. Показателем титрования применяемого индикатора.
С. Величиной константы титрования.
Д. Свойствами применяемого титранта.
Е. Скоростью реакции между анализируемым веществом и титрантом.
82. На основании, каких данных судят о количестве определяемого вещества в титриметрических методах анализа?
А. Объема титранта, вступившего в реакцию с определяемым веществом.*
В. Концентрации реагента, вступившего в реакцию с определяемым веществом.
С. Массы реагента, вступившего в реакцию с определяемым веществом.
Д. Объемов титранта и исследуемого раствора, вступивших в реакцию.
83. Подберите первичный стандарт для стандартизации раствора серной кислоты:
А. Дифенилгуанидин.*
В. Хлороводородная кислота.
С. Бензойная кислота.
Д. Натрия гидрокарбонат.
Е. Калия гидроксид.
84. Подберите первичный стандарт для стандартизации раствора натрия гидроксида:
А. Бензойная кислота.*
В. Хлороводородная кислота.
С. Дифенилгуанидин.
Д. Натрия гидрокарбонат.
Е. Калия гидроксид.
85. Подберите первичный стандарт для стандартизации раствора калия гидроксида:
А. Бензойная кислота.*
В. Хлороводородная кислота.
С. Дифенилгуанидин.
Д. Натрия гидрокарбонат.
Е. Калия гидроксид.
86. Подберите первичный стандарт для стандартизации раствора азотной кислоты:
|
|
|
А. Дифенилгуанидин.*
В. Хлороводородная кислота.
С. Бензойная кислота.
Д. Натрия гидрокарбонат.
Е. Калия гидроксид.
87. Подберите первичный стандарт для стандартизации раствора бария гидроксида:
А. Бензойная кислота.*
В. Хлороводородная кислота.
С. Дифенилгуанидин.
Д. Натрия гидрокарбонат.
Е. Калия гидроксид.
88. Для построения кривой титрования слабого основания сильной кислотой рН до начала титрования рассчитывают по формуле:
А. 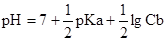 *
*
В. 
С. 
Д. 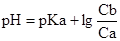
Е. 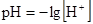
89. Для построения кривой титрования слабого основания сильной кислотой рН в момент полунейтрализации рассчитывают по формуле:
А. 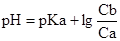 *
*
В. 
С. 
Д. 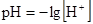
Е. 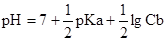
90. Для построения кривой титрования слабого основания сильной кислотой рН в начале скачка титрования рассчитывают по формуле:
А. 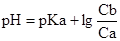 *
*
В. 
С. 
Д. 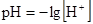
Е. 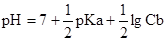
91. Для построения кривой титрования слабого основания сильной кислотой рН в точке эквивалентности рассчитывают по формуле:
А.  *
*
В. 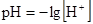
С. 
Д. 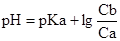
Е. 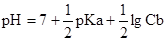
92. Для построения кривой титрования слабого основания сильной кислотой рН в конце скачка титрования рассчитывают по формуле:
А. 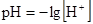 *
*
В. 
С. 
Д. 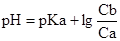
Е. 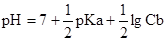
93. Как титруется в присутствии индикаторов щавелевая кислота H2C2O4: K1 = 5,6•10-2,
K2 = 5,4•10-5?
А. Как двухосновная кислота.*
В. Как одноосновная кислота.
С. И то, и другое.
Д. Ни то, ни другое.
94. Как титруется в присутствии индикаторов ортоборная кислота H3BO4:K1 = 7,1•10-10,
K2 = 1,8•10-13, K3 = 1,6•10-14?
А. Как одноосновная кислота.
В. Как двухосновная кислота.
С. И то, и другое.
Д. Ни то, ни другое.*
95. Как титруется в присутствии индикаторов малоновая кислота HOOCCH2COOH: K1 = 4,2•10-2,
K2 = 2,1•10-6?
А. Как одноосновная кислота.
В. Как двухосновная кислота.
С. И то, и другое.*
Д. Ни то, ни другое
96. Как титруется в присутствии индикаторов глутаровая кислота HOOC(CH2)3COOH: K1 = 4,6•10-5, K2 = 5,4•10-6?
А. Как двухосновная кислота.*
В. Как одноосновная кислота.
С. И то, и другое.
Д. Ни то, ни другое.
97. Как титруется в присутствии индикаторов угольная кислота H2CO3: K1 = 4,5•10-7,
K2 = 4,8•10-11?
А. Как одноосновная кислота.
В. Как двухосновная кислота.
С. И то, и другое.
Д. Ни то, ни другое.*
98. По методу кислотно-основного титрования прямым титрованием можно определять:
А. Сильные кислоты.
В. Слабые кислоты с определенным значением Ка
С. Слабые основания с определенным значением Кb
|
|
|
Д. Сильные основания.
Е. Вещества с кислотно-основными свойствами, если Ka(b) ≥ 5•10-7*
99. Подберите подходящий методический прием, если вещество реагирует с титрантом стехиометрически с достаточной скоростью:
А. Способ прямого титрования.*
В. Способ обратного титрования
С. Титрование по замещению.
Д. Титрование с инструментальным фиксированием точки эквивалентности.
Е. Метод взятия отдельных навесок.
100. Подберите подходящий методический прием, если вещество реагирует с титрантом стехиометрически, но медленно:
А. Способ обратного титрования*
В. Способ прямого титрования.
С. Титрование по замещению.
Д. Титрование с инструментальным фиксированием точки эквивалентности.
Е. Метод взятия отдельных навесок.
101. Подберите подходящий методический прием, если вещество реагирует с титрантом стехиометрически и быстро, но нельзя подобрать индикатор.
А. Титрование с инструментальным фиксированием точки эквивалентности.*
В. Способ прямого титрования.
С. Титрование по замещению.
Д. Способ обратного титрования
Е. Метод взятия отдельных навесок.
102. Подберите подходящий методический прием, если вещество реагирует с титрантом быстро, но не стехиометрически:
А. Титрование по замещению.*
В. Способ прямого титрования.
С. Способ обратного титрования
Д. Титрование с инструментальным фиксированием точки эквивалентности.
Е. Метод взятия отдельных навесок.
103. Подберите подходящий методический прием, если вещество непосредственно не взаимодействует с тирантом:
А. Титрование по замещению.*
В. Способ прямого титрования.
С. Способ обратного титрования.
Д. Титрование с инструментальным фиксированием точки эквивалентности.
Е. Метод взятия отдельных навесок.
104. Расчет рН раствора сильной кислоты, производят по формуле:
А. 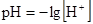 *
*
В. 
С. 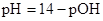
Д. 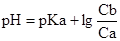
Е. 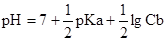
105. Расчет рН раствора слабой кислоты, производят по формуле:
А.  *
*
В. 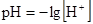
С. 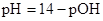
Д. 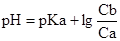
Е. 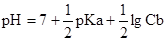
106. Расчет рН раствора сильного основания, производят по формуле:
А. 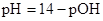 *
*
В. 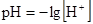
С. 
Д. 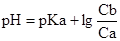
Е. 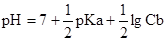
107. Расчет рН раствора слабого основания, производят по формуле:
А. 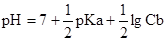 *
*
В. 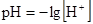
|
|
|
С. 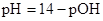
Д. 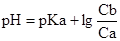
Е. 
108. Расчет рН раствора, содержащего слабую кислоту и соль этой кислоты, производят по формуле:
А. 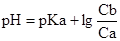 *
*
В. 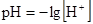
С. 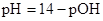
Д. 
Е. 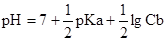
109. Какие индикаторы применяют при титровании раствора NaOH раствором хлороводородной кислоты?
А. Метиловый оранжевый.
В. Фенолфталеин.
С. И то, и другое.*
Д. Ни то, ни другое.
110. Какие индикаторы применяют при титрования раствора NH3 раствором хлороводородной кислоты?
А. Фенолфталеин.
В. Метиловый оранжевый.*
С. И то, и другое.
Д. Ни то, ни другое.
111. Какие индикаторы применяют при титровании раствора CH3COOH раствором щелочи?
А. Фенолфталеин.*
В. Метиловый оранжевый.
С. И то, и другое.
Д. Ни то, ни другое.
112. Для проведения анализа титриметрическим методом необходимо наличие:
А. Мерной посуды для точного отмеривания объемов.
В. Мерной посуды не для точного отмеривания объемов.
С. Индикаторов или приборов для фиксирования точки эквивалентности.
Д. Титрованных растворов.
Е. Всего выше перечисленного.*
113. Укажите способы подбора рН-индикаторов:
А. Качественный и количественный.*
В. Пипетирование и отдельных навесок.
С. Прямые и косвенные.
Д. Приготовленного и установленного титра.
Е. Индикаторные и инструментальные.
114. Укажите способы титрования:
А. Прямые и косвенные.*
В. Качественный и количественный.
С. Пипетирование и отдельных навесок.
Д. Приготовленного и установленного титра.
Е. Индикаторные и инструментальные.
115. Укажите методы титрования:
А. Пипетирование и отдельных навесок.*
В. Качественный и количественный.
С. Прямые и косвенные.
Д. Приготовленного и установленного титра.
Е. Индикаторные и инструментальные.
116. Укажите способы приготовления титрованных растворов:
А. Приготовленного и установленного титра.*
В. Качественный и количественный.
С. Прямые и косвенные.
Д. Пипетирование и отдельных навесок.
Е. Индикаторные и инструментальные.
117. Укажите способы фиксирования точки конца титрования:
А. Индикаторные и инструментальные.*
В. Качественный и количественный.
С. Прямые и косвенные.
Д. Приготовленного и установленного титра.
Е. Пипетирование и отдельных навесок.
118. Какие растворы можно стандартизовать с помощью первичного стандарта калия гидрофталата в водных растворах?
А. Раствор кислоты.
В. Раствор щелочи.
С. И то, и другое.*
Д. Ни то, ни другое.
119. Какие растворы можно стандартизовать с помощью первичного стандарта натрия тетрабората в водных растворах?
А. Раствор кислоты.*
В. Раствор щелочи.
С. И то, и другое.
Д. Ни то, ни другое.
120. Какие растворы можно стандартизовать с помощью первичного стандарта щавелевой кислоты в водных растворах?
А. Раствор щелочи.*
В. Раствор кислоты.
С. И то, и другое.
Д. Ни то, ни другое.
121. Какие растворы можно стандартизовать с помощью первичного стандарта янтарной кислоты в водных растворах?
А. Раствор щелочи.*
В. Раствор кислоты.
С. И то, и другое.
Д. Ни то, ни другое.
122. Какие растворы можно стандартизовать с помощью первичного стандарта натрия сульфата в водных растворах?
А. Раствор кислоты.
В. Раствор щелочи.
С. Ни то, ни другое.*
Д. И то, и другое.
123. Одной из основных характеристик рН-индикаторов является:
А. Показатель титрования.*
В. Константа кислотности.
С. Молярная масса.
Д. Концентрация применяемого индикатора.
Е. Количество добавленного индикатора.
124. Вещество можно оттитровать по методу кислотно-основного титрования, если константа титрования имеет значение:
А. KТ больше 10-4–10-5.
В. KТ меньше 10-4–10-5.*
С. KТ больше 10-3.
Д. KТ равна 10-5.
Е. KТ равна 10-2.
125. Укажите наиболее часто встречающийся способ выражения концентрации титрантов:
А. Молярная. *
В. Мольная доля.
С. Массовая доля.
Д. Моляльная.
С. Процентная.
126. Укажите, как титруется в водных средах с визуальным фиксированием точки эквивалентности полипротонная кислота – аскорбиновая, Ка1 = 9,1•10-5, Ка2 = 4,6•10-12:
А. Как однопротонная кислота.*
В. Как двухпротонная.
С. И то, и другое.
Д. Ни то, ни другое.
127. Укажите, как титруется в водных средах с визуальным фиксированием точки эквивалентности полипротонная кислота - глутаминовая, Ка1 = 4,7•10-5, Ка2 = 8,7•10-11:
А. Как однопротонная кислота.*
В. Как двухпротонная.
С. И то, и другое.
Д. Ни то, ни другое.
128. Укажите, как титруется в водных средах с визуальным фиксированием точки эквивалентности полипротонная кислота – малеиновая, Ка1 = 1,2•10-2, Ка2 = 6,0•10-7:
А. Как однопротонная кислота.
В. Как двухпротонная.
С. И то, и другое.*
Д. Ни то, ни другое.
129. Для приготовления и анализа лекарственных препаратов широко используют буферные растворы. Буферные растворы используют для:
А. Поддержания определенного значения величины рН раствора.*
В. Изменения величины рН раствора.
С. Изменения константы ионизации вещества.
Д. Изменения ионной силы раствора.
Е. Изменения произведения растворимости вещества.
130. Выберите пару титрантов для определения СН3СООН методом обратного титрования:
A. NaOH, KOH
B. NaOH, AgNO3
C. HCl, H2SO4
D. NaOH, HCl *
E. NH4NCS, AgNO3
131. Укажите значение фактора эквивалентности Na2CO3, при количественном определении согласно реакции:
Na2CO3 + HCl = NaCl + NaHCO3
A. f=l/2
B. f-4
C. f=l *
D. f-2
E. f=l/4
132. Растворители, используемые в аналитической химии, классифицируют по их способности присоединять или отдавать протоны. Укажите, к каким растворителям относятся спирты:
A. Протогенные
B. Протогенные и амфипротные
C. Апротонные
D. Амфипротные*
E. Протофильные
133. К 10,00 см3 0,1000 моль/дм3 раствора хлоридной кислоты добавили 12,00 см3 0,1000 моль/дм3 раствора натрия гидроксида. Какой будет окраска раствора в присутствии фенолфталеина?
A. Желтой
B. Бесцветной
C. Красной
D. Малиновой *
E. Оранжево-розовой
134. Укажите посуду, которую используют в титриметрических методах анализа для измерения точного объема титранта:
A. Мерный цилиндр
B. Мерная колба
C. Бюретка *
D. Пипетка
E. Мензурка
135. На аналитических весах можно взвешивать с точностью до:
А. 0,0001 г *
В. 0,01 г
С. 0,001 г
Д. 0,1 г
Е. 1 г
136. Методом кислотно-основного титрования определяют:
А. Кислоты, основания и соли, которые гидролизуются *
В. Только сильные кислоты
С. Только сильные основания.
Д. Только сильные кислоты и слабые основания
Е. Только соли, которые гидролизуются
137. Для выбора индикатора в методе кислотно-основного титрования строят кривую титрования, которая представляет собой зависимость:
А. рН раствора от объема добавленного титранта *
В. рН раствора от концентрации раствора добавленного титранта
С. рН раствора от объема анализируемого раствора
Д. Концентрации анализируемого раствора от Н раствора
Е. рН раствора от температуры
138. На аналитических весах массу летучего анализируемого вещества взвешивают:
А. В бюксе *
В. В химическом стакане
С. На фильтровальной бумаге «Синяя лента»
Д. На фильтровальной бумаге «Белая лента»
Е. На стеклянном фильтре
139. Укажитепорядок проведения обратного титрования:
А. К раствору точной концентрации, находящемуся в колбе для титрования, добавляется анализируемый раствор из бюретки.
В. К анализируемому раствору добавляется точный объем стандартного раствора (титрант 1), избыток которого оттитровывается другим стандартным раствором (титрант 2).*
С. К анализируемому раствору добавляется определенный реагент, продукт реакции оттитровывается подходящим титрантом.
Д. К анализируемому раствору добавляется титрант из бюретки до наступления точки эквивалентности
Е. К точному объему стандартного раствора (титрант 1) добавляется анализируемый раствор, избыток которого оттитровывается другим стандартным раствором (титрант2).
140. Укажите порядок проведения прямого титрования:
А. К анализируемому раствору добавляют основной и вспомогательный титранты одновременно.
В. К анализируемому раствору добавляют точное количество первого титранта, избыточное количество которого оттитровывают вторым титрантом.
С. К анализируемому раствору добавляют основной титрант до изменения цвета индикатора, затем вспомогательный титрант до точки эквивалентности.
Д. К анализируемому раствору добавляют титрант из бюретки до наступления точки эквивалентности.*
Е. К анализируемому раствору добавляют определенный реагент, а титрант взаимодействует с продуктом первой реакции.
141. Укажите, какой стандартный раствор (титрант) используют при определении очень слабых органических оснований:
А. Водным раствором НСl
В. Водным раствором HСlO4
С. Раствором HCl в метаноле.
Д. Раствором HClO4 в ледяной уксусной кислоте.*
Е. Раствором HClO4 в диметилформамиде.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 1200; Нарушение авторских прав?; Мы поможем в написании вашей работы!