
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: основные термодинамические процессы
|
|
|
|
ЛЕКЦИЯ № 7
Основными термодинамическими процессами являются:
1) Изохорный процесс - процесс сообщения или отнятия теплоты при постоянном объёме газа (V=const);
2) Изобарный процесс - процесс сообщения или отнятия теплоты при постоянном давлении (Р=const);
3) Изотермический процесс - процесс сообщения или отнятия теплоты при постоянной температуре (t=const);
4) Адиабатный процесс – процесс, при котором отсутствует теплообмен с окружающей средой (dq=0);
5) Политропный процесс - процесс, в котором изменение параметров подчиняется уравнению  , где m - величина, постоянная для данного процесса
, где m - величина, постоянная для данного процесса
Метод исследования процессов состоит в следующем:
1. Выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
2. Вычисляется работа изменения объема газа;
3. Определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
4. Определяется изменение внутренней энергии системы в процессе;
5. Определяется изменение энтропии системы в процессе.
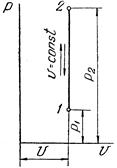
1 Изохорный процесс (V=const)
Для графического метода исследования процессов используется координатная система p-v.
Изохорный процесс в pv-диаграмме изображается отрезком прямой 1-2, идущим параллельно оси ординат. Прямая 1-2 называется изохорой.
При направлении от точки 1 к точке 2 процесс идёт с сообщением теплоты, при направлении от точки 2 к точке 1 – с отводом теплоты.
 | |||
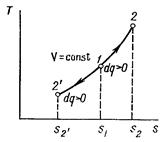 | |||
Рисунок 1 – Изохорный процесс в pv- и TS-диаграмме
Уравнение изохоры имеет вид  , (1)
, (1)
Зависимость между начальными и конечными параметрами процесса выражается
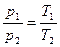 , (2)
, (2)
Изменение внутренней энергии определяется
 , (3)
, (3)
Если в процессе участвует М, кг или Vн, м3 газа, то количество теплоты (изменение внутренней энергии газа) определяется
 , (4)
, (4)
где  - количество газа при нормальных условиях, м3.
- количество газа при нормальных условиях, м3.
Если количество теплоты необходимо подсчитать, пользуясь нелинейной зависимостью теплоёмкости от температуры, то применяют следующие формулы:
- количество теплоты, затрачиваемой для нагревания 1кг газа в интервале температур от t1 до t2 при постоянном объёме
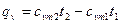 , (5)
, (5)
- если в процессе участвуют М, кг или Vн, м3 газа, то
 , (6)
, (6)
В изохорном процессе из-за отсутствия расширения газа работа L=0, и подводимая к газу теплота полностью идёт на изменение его внутренней энергии.
Изменение энтропии в изохорном процессе  (7)
(7)
2 Изобарный процесс (Р=const)
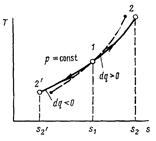
Изобарный процесс в pv-диаграмме изображается отрезком прямой 1-2, идущим параллельно оси абсцисс. Прямая 1-2 называется изобарой.
При направлении от точки 1 к точке 2 процесс идёт с сообщением теплоты. Работа в этом случае имеет положительное значение. При направлении от точки 2 к точке 1 – с отводом теплоты, и работа имеет отрицательное значение.
 | |||
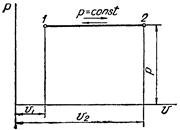 | |||
Рисунок 2 – Изобарный процесс в pv- и TS-диаграмме
Уравнение изобары имеет вид  , (8)
, (8)
Зависимость между начальными и конечными параметрами процесса выражается
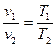 , (9)
, (9)
Работа 1кг газа определяется по формуле
 , (10)
, (10)
или 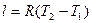 , (11)
, (11)
Для М, кг газа работа определяется
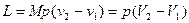 , (12)
, (12)
или  , (13)
, (13)
где 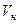 - количество газа при нормальных условиях, м3.
- количество газа при нормальных условиях, м3.
Если количество теплоты необходимо подсчитать, пользуясь нелинейной зависимостью теплоёмкости от температуры, то применяют формулы
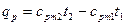 , (14)
, (14)
- если в процессе участвуют М, кг или Vн, м3 газа, то
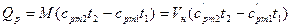 , (15)
, (15)
Изменение внутренней энергии определяется
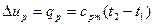 , (16)
, (16)
Изменение энтропии в изобарном процессе
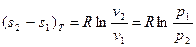 (17)
(17)
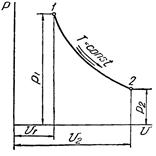
3 Изотермический процесс (t=const)
Изотермический процесс в pv-диаграмме изображается равнобокой гиперболой 1-2, для которой координатные оси служат асимптотами. Гипербола 1-2 называется изотермой.
При направлении от точки 1 к точке 2 процесс идёт с сообщением теплоты. Работа в этом случае имеет положительное значение. При направлении от точки 2 к точке 1 – с отводом теплоты, и работа имеет отрицательное значение.
 | |||
 | |||
Рисунок 3 – Изотермический процесс в pv- и TS-диаграмме
Уравнение изотермы имеет вид  , (18)
, (18)
Зависимость между начальными и конечными параметрами процесса выражается
 , (19)
, (19)
Работа 1кг идеального газа определяется уравнениями
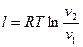 , (20)
, (20)
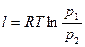 , (21)
, (21)
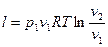 , (22)
, (22)
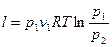 , (23)
, (23)
Так как в изотермическом процессе t=const, то изменение внутренней энергии определяется  , (24)
, (24)
Количество теплоты, сообщаемой газу или отнимаемой от него, определяется
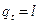 , (25)
, (25)
для М, кг газа 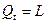 , (26)
, (26)
Натуральный логарифм, входящий в формулы, может быть заменён десятичным по соотношению lgN = 2,303 lgN. 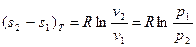 (27)
(27)
4 Адиабатный процесс (dq=0)
Основным условием адиабатного процесса является полное отсутствие теплообмена между средой и рабочим телом (газом). Адиабатный процесс в pv-диаграмме изображается неравнобокой гиперболой 1-2, не пересекающую координатных осей. Гипербола называется адиабатой. Адиабата располагается круче изотермы.
 | |||
 | |||
Рисунок 4 – Адиабатный процесс в pv- и TS-диаграмме
Уравнение адиабаты имеет вид  , где
, где  - показатель адиабаты. (28)
- показатель адиабаты. (28)
Зависимость между начальными и конечными параметрами процесса:
между p и v  , (29)
, (29)
между Т и v  , (30)
, (30)
между p и T  , (31)
, (31)
Работа 1кг газа определяется по следующим формулам
 , (32)
, (32)
 , (33)
, (33)
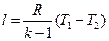 , (34)
, (34)
 , (35)
, (35)
Уравнение первого закона термодинамики для адиабатного процесса имеет вид
 , (36)
, (36)
 , (37)
, (37)
Изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку.
Изменение энтропии в адиабатном процессе
 , s=const (38)
, s=const (38)
5 Политропный процесс ( )
)
Политропным процессом описывается любой закономерный процесс или совокупность отдельных закономерных процессов.
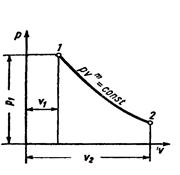 |
Рисунок 5 – Политропный процесс в pv- диаграмме
Уравнение политропы при постоянной теплоёмкости имеет вид
 , (39)
, (39)
где m - показатель политропы.
Характеристикой политропного процесса является величина
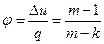 , (40)
, (40)
где  .
.
По величине показателя политропы m можно определить её относительное расположение в pv-диграмме и выяснить характер процесса, т.е. есть ли подвод или отвод теплоты, увеличение или уменьшение внутренней энергии газа.
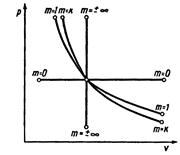 |
Для процессов расширения:
1) m>1 – теплота подводится (q>0), внутренняя энергия газа увеличивается ( >0);
>0);
2) к>m>1 – теплота подводится (q>0), внутренняя энергия газа уменьшается ( <0);
<0);
3) m>к – теплота отводится (q<0), внутренняя энергия газа уменьшается ( <0).
<0).
Для процессов сжатия:
1) m<1 – теплота отводится, внутренняя энергия газа уменьшается;
2) к>m>1 – теплота отводится, внутренняя энергия газа увеличивается;
3) m>к – теплота подводится, внутренняя энергия газа увеличивается.
Зависимость между начальными и конечными параметрами процесса:
между p и v  , (41)
, (41)
между Т и v 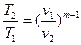 , (42)
, (42)
между p и T 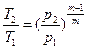 , (43)
, (43)
Работа 1кг газа определяется по следующим формулам
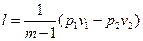 , (44)
, (44)
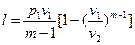 , (45)
, (45)
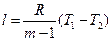 , (46)
, (46)
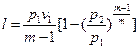 , (47)
, (47)
Если количество теплоты, участвующей в процессе, известно, то работа может быть определена  , (48)
, (48)
Теплоёмкость политропного процесса определяется  , (49)
, (49)
Количество теплоты, сообщаемой газу или отнимаемой от него, определяется
 , (50)
, (50)
Изменение внутренней энергии газа определяется
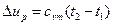 , (51)
, (51)
 , (52)
, (52)
 , (53)
, (53)
Показатель политропного процесса определяется  , (54)
, (54)
Изменение энтропии в политропном процессе
s2 –s1 = c ln T 2 / T1, где c = cv [ (m-k) / (m-1) ] (55)
|
|
|
|
|
Дата добавления: 2014-11-08; Просмотров: 1159; Нарушение авторских прав?; Мы поможем в написании вашей работы!