
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Двойной электрический слой
|
|
|
|
Потенциалы, гальванические элементы
Электрохимические реакции, электродные
Электрохимические реакции представляют собой процесс обратный электролизу. При электролизе электрическая энергия превращается в химическую, в электрохимических реакциях, химическая энергия превращается в электрическую.
Электрохимическим (гальваническим) элементом наз. устройство для получения электрического тока за счет протекания электрохимических реакций. Несколько электрохимических элементов, соединенных последовательно, образуют электрохимическую цепь.
Важнейшей количественной характеристикой электрохимического элемента или цепи является электродвижущая сила (ЭДС), которая равна разности потенциалов между концами проводников первого рода, присоединенных к конечным электродам элемента.
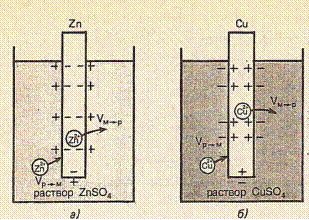
Работа гальванических элементов основана главным образом на том, что на металлических проводниках, опущенных в растворы их солей, возникает скачок потенциала.
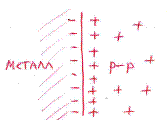
При погружении металла в раствор начинается его сложное взаимодействие с компонентами раствора. Наиболее важной является реакция поверхностных атомов металла, находящихся в узлах кристаллической решетки, с полярными молекулами воды, находящимися у поверхности электрода. В результате этого взаимодействия происходит окисление металла и его гидратированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле.
M + m·H2O ↔ M(H2O)m+n + n·e.
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл-раствор образуется двойной электрический слой и возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода.
| 
|
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной растет. При некотором значении электродного потенциала скорости обоих процессов сравняются и устанавливается равновесие:
M ↔ M+n + n·e.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, наз. равновесным электродным потенциалом.
Его величина определяется с помощью уравнения потенциала отдельного электрода – уравнения Нернста:
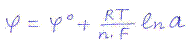

Это уравнение выражает зависимость потенциала электрода от концентрации его ионов в растворе. Значения φ0 определенные при стандартных условиях (Р = 1 атм, t = 250C, а = 1) наз. стандартным потенциалом данного электрода. По значению этого потенциала металлы располагаются в ряд напряжений.
Классификация электродов
Электроды можно разделить на три типа:
1. первого рода, обратимые по отношению к катиону;
2. второго рода, обратимые по отношению к аниону и катиону;
3. окислительно-восстановительные.
К электродам первого рода относятся металлические электроды, погруженные в раствор соли того же металла.
К электродам второго рода относятся электроды, в которых металл покрыт слоем его малорастворимой соли и находится в растворе, насыщенном этой солью и содержащем другую, легкорастворимую соль с тем же анионом (напр. Ag + AgCl + KCl).
Окислительно-восстановительные электроды не обменивают с раствором ни катионов, ни анионов, а только обеспечивают подвод и отвод электронов для окислительно-восстановительной реакции, протекающей в растворе между ионами растворенного вещества.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 752; Нарушение авторских прав?; Мы поможем в написании вашей работы!