
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виды электродов
|
|
|
|
1. Металлический электрод. Он является электродом первого рода и представляет собой металл, погруженный в раствор его соли. Его потенциал определяется уравнением Нернста:

Отсюда видно, что потенциал металлического электрода зависит только от концентрации катионов металла и не зависит от концентрации анионов.
2. Водородный электрод. Он также относится к электродам первого рода. Его стандартный потенциал условно принят за нуль. Его используют в качестве электрода сравнения, относительно которого измеряются потенциалы других электродов. Он представляет собой платиновую пластинку, погруженную в раствор, содержащий ионы водорода, например, в раствор серной кислоты. Через раствор пропускают ток чистого водорода

| при постоянном давлении (Р = 1 атм). Газообразный водород адсорбируется на платине и затем распадаясь на атомы переходит в раствор в виде ионов. Между атомами водорода на платине и ионами водорода в растворе устанавливается равновесие: H2 ↔ 2H+ + 2e. |
Схематически водородный электрод записывается следующим образом:
H2(Pt) │H+.
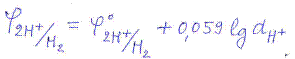
Для водородного электрода φ0 = 0, отсюда:
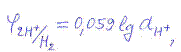
так как  , то
, то

Т. о., потенциал водородного электрода зависит от активности ионов водорода и, следовательно, его можно применять для измерения рН. Водородный электрод является самым точным электродом для измерения кислотности среды в широком интервале рН. В тоже время ему присущи некоторые недостатки.
В настоящее время потенциалы отдельных электродов измеряют не относительно водородного электрода, а относительно, так наз. электродов сравнения, потенциал которых известен, измерен относительно водородного электрода и является стабильным в работе. В качестве таких электродов применяют хлорсеребряный, каломельный и стеклянный электроды.
3. Хлорсеребряный электрод. Он относится к электродам второго рода, прост в изготовлении и дает хорошо воспроизводимые результаты.
Ag | AgCl, KCl.

| 1 – серебро; 2 – хлорид серебра; 3 – насыщенный раствор AgCl в растворе KCl; 4 – медный проводник; 5 – стеклянный чехол; 6 – соединительный отвод; 7 – сосуд. |
На границе раздела металл-раствор хлорсеребряного электрода протекает следующая электродная реакция:
AgCl + e ↔ Ag + Cl-
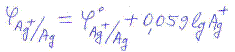
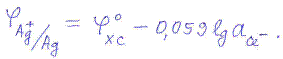
4. Каломельный электрод. Он аналогичен по устройству хлорсеребряному и состоит из металлической ртути, которая находится на дне сосуда, а сверху покрыта пастой из каломели Hg2Cl2. Сосуд наполнен раствором KCl определенной концентрации, насыщенном Hg2Cl2.
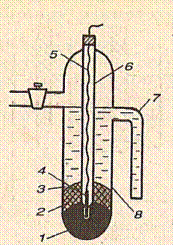
| 1 – ртуть; 2 – паста из каломели; 3 – насыщенный раствор каломели в растворе хлорида; 4 – платина; 5 – медный проводник; 6 – стеклянный чехол; 7 – соединительный отвод; 8 – сосуд. | |
| Hg | Hg2Cl2, KCl 2Hg ↔ Hg2+2 + 2e Hg2+2 + 2 Cl- ↔ Hg2Cl2. |

| |
Его потенциал также обратим относительно анионов:

5. Хингидронный электрод. Он является представителем окислительно-восстановительных электродов.
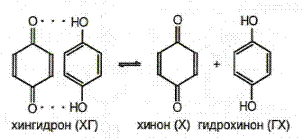
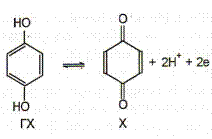
Схема электрода: Pt | X, ГХ, Н+.

Концентрации хинона и гидрохинона в растворе равны, так как они образуются в результате диссоциации хингидрона. Поэтому:
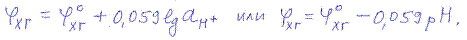
Хингидронный электрод удобен в работе и позволяет определять рН кислых и слабощелочных растворов. В щелочных растворах (при рН > 8) он не дает точных показаний из-за диссоциации гидрохинона, в результате чего его концентрация уменьшается. Присутствие в растворах окислителей и восстановителей также влияет на потенциал хингидронного электрода.
6. Стеклянный электрод. Он является ионоселективным электродом. В нем происходит обмен между ионами, а не электронами.

| Стеклянный электрод представляет собой трубку из специального стекла в выдутым на ее конце шариком с очень тонкой стенкой. Внутрь электрода заливается раствор электролита с известной величиной рН (раствор HCl, pH = 1) и помещают электрод сравнения – хлорсеребряный электрод: Ag | AgCl, HCl | стекло | Н+ (раствор). |
Мембрана электрода, изготовленная из натриевого или литиевого стекла, обладает катионообменными свойствами, т. к. в водном растворе ионы щелочного металла гидратируясь, могут обмениваться только с ионами водорода внутреннего и внешнего растворов:
Н+(раствор) + Na+(стекло) ↔ Н+(стекло) + Na+(раствор).
В результате этого стеклянная мембрана приобретает свойства ионного проводника и является проницаемой только для ионов водорода (рН – селективная мембрана).
Стеклянные электроды являются лучшими рН-электродами, они не чувствительны к окислительно-восстановительным системам и работают в широком диапазоне рН: от – 1 до + 14.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1884; Нарушение авторских прав?; Мы поможем в написании вашей работы!