
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионная связь
|
|
|
|
Ионная связь образуется между атомами с резко различной электроотрицательностью (в молекулах солей, оксидов и гидроксидов).
Рассмотрим образование ионной связи в молекуле NaCl:
NaCl: Na K L 3s1 Na0 - 1 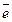
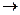 Na+
Na+
Cl K L 3s2 3p5 Cl0 + 1 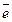
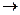 Cl-
Cl-
Na+ + Cl- 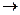 Na+ Cl-
Na+ Cl-
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей (рис.1).
Ионная связь ненасыщена, т.к. ион способен взаимодействовать с соседними ионами противоположного знака и ненаправлена, т.к. электрическое поле иона имеет сферический характер.
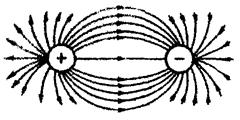
Рис.1. Распределение электрических силовых линий двух разноименных ионов.
Соединения с ионным типом химической связи, как правило, тугоплавки,являются типичными электролитами и обладают кристаллической ионной решеткой.
Общая энергия ионной связи складывается по формуле:
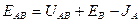 ,
,
где 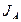 - потенциал ионизации;
- потенциал ионизации; 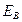 - энергия сродства;
- энергия сродства; 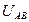 - потенциальная энергия.
- потенциальная энергия.
3. Ковалентная связь. Метод валентных связей. Типы ковалентных молекул. Понятие о методе молекулярных орбиталей
Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной связью.
В 1919 году впервые теорию о ковалентной связи высказал американский ученый Г. Льюс. А в 1925 году В. Гейтлер и Ф. Лондон, опираясь на теорию Льюиса, решили уравнение Шредингера для молекулы водорода. Квантово-механические расчеты показали, что химическая связь образуется в результате перекрывания электронных облаков взаимодействующих атомов (рис.2).
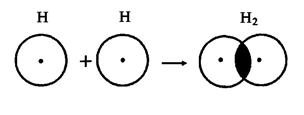
Рис.2. Перекрывание электронных облаков при образовании молекулы водорода.
При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков. Электронная плотность в межъядерном пространстве увеличивается, ядра притягиваются к этой зоне, и энергия системы понижается (рис.3). Однако, при очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи. Волновые функции атомов при этом складываются. Это становится возможным в том случае, если электроны взаимодействующих атомов имеют антипараллельные спины.
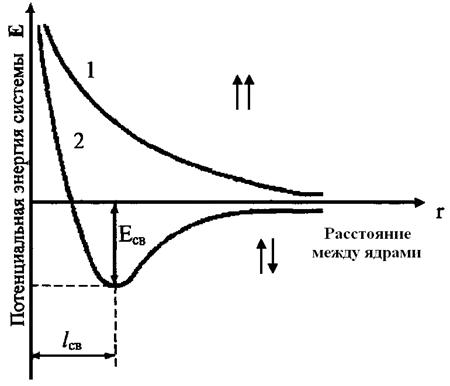
Рис.3. Зависимость энергии систем из двух атомов с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами.
При сближении атомов с параллельными спинами волновые функции атома вычитаются, энергия возрастает, и молекула не образуется.
Особенностями ковалентной химической связи являются ее направленность, насыщаемость, полярность и поляризуемость. Насыщаемость ковалентной связи определяется ограничением числа электронов, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи. Так как атомные орбитали пространственно ориентированны, то перекрывание электронных облаков происходит по определенным направлениям, что и обуславливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах и твердых телах.
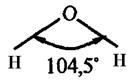
Валентный угол -это уголмежду воображаемыми линиями, проходящими через ядра химически связанных атомов. В молекуле воды он составляет 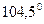 .
.
Так строение молекулы воды можно выразить структурной формулой:
В волновой механике для описания ковалетной связи рассматривают два квантово-механических метода:
1) метод валентных связей;
2) метод молекулярных орбиталей.
Метод валентных связей рассматривает молекулу как систему из суммы отдельных связей. Такое представление не характеризует химическую реакционную способность молекул с большим числом связей.
Метод валентных связей включает 3 основных положения:
1) связь образована двумя электронами с антипараллельными спинами;
2) ковалентная связь насыщена и направлена в сторону максимального перекрывания электронных облаков в атомах, тем самым определяется геометрия молекулы;
3) если атомы вступают во взаимодействие электронами разного вида, их орбитали и энергии гибридизуются. При этом связи за счет перекрывания гибридных облаков становятся более прочными (область перекрывания облаков и энергия связи увеличивается).
Одно из важнейших свойств химической связи - ее насыщаемость. Вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде дискретных частиц с определенной структурой.
Теория валентных связей (локализованных электронных пар) исходит из положения, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Таким образом, в представлении теории валентных связей химическая связь локализована между двумя атомами, т.е. она двухцентровая и двухэлектронная.
Валентность атома - это свойство атома данного элемента присоединять или замещать определенное число химических связей, образуемых данным атомом с другими атомами. В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Например, атомы кислорода и азота могут соединяться с двумя и тремя (соответственно) одновалентными атомами водорода:
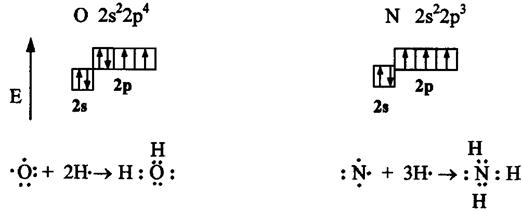
Рассмотрим валентные возможности атомов бериллия, бора, углерода и азота. Это - элементы 2-го периода и, следовательно, их валентные электроны распределяются по четырем орбиталям внешнего слоя: одной 2s- и трем 2p - орбиталях.
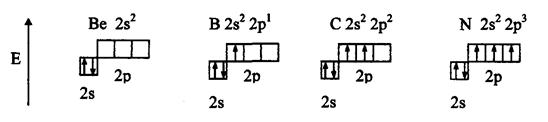
Поскольку у бериллия, бора и углерода имеются энергетически близкие свободные 2p-орбитали, при возбуждении эти элементы могут приобрести новые электронные конфигурации:
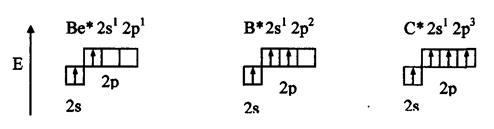
В соответствии с числом непарных электронов атомы Be,B,C и N могут образовать соответственно две, три, четыре и три ковалентные связи, например, с атомами водорода:
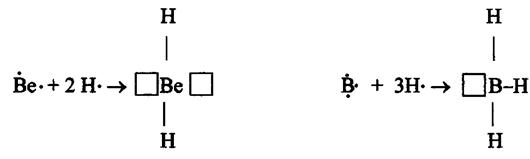
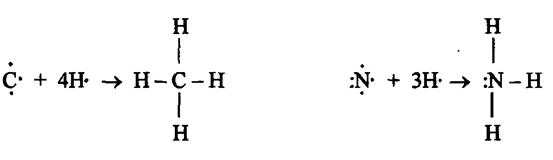
Атом бериллия и бора имеют свободные орбитали, поэтому в молекулах 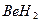 и
и 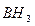 - дефицит электронов. В молекуле же
- дефицит электронов. В молекуле же 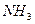 при атоме азота имеется неподеленная (несвязывающая) электронная пара. Таким образом, молекулы
при атоме азота имеется неподеленная (несвязывающая) электронная пара. Таким образом, молекулы 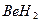 и
и 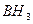 могут выступать как акцепторы, а молекула
могут выступать как акцепторы, а молекула 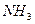 , наоборот, - как донор электронной пары. Иными словами, центральные атомы этих молекул способны к образованию четвертой ковалентной связи по донорно - акцепторному механизму.
, наоборот, - как донор электронной пары. Иными словами, центральные атомы этих молекул способны к образованию четвертой ковалентной связи по донорно - акцепторному механизму.
Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и двухэлектронными облаками или соответственно наличием свободных орбиталей.
Геометрия молекулы определяется направлением перекрывания атомных орбиталей. В зависимости от способа перекрывания и симметрии образующегося облака различают 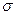 -,
-,  - и
- и 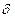 - связи(рис.4). Кроме простых
- связи(рис.4). Кроме простых
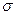 - связей существуют кратные(двойные и тройные) связи, которые образуются при наложении
- связей существуют кратные(двойные и тройные) связи, которые образуются при наложении 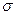 -,
-,  - и
- и 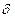 - связей.
- связей.
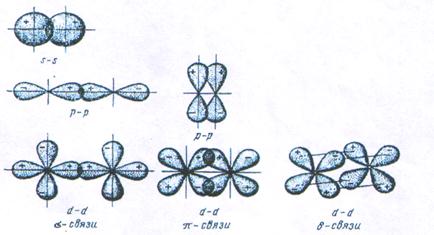
Рис.4. Перекрывание атомных орбиталей при образовании 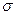 -,
-,  - и
- и 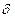 - связей.
- связей.
Сигма - связь (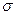 -) - это связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
-) - это связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
Максимальное перекрывание облаков, образующих 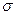 - связи, совпадает с линией, соединяющей центры атомов. Пространственное расположение
- связи, совпадает с линией, соединяющей центры атомов. Пространственное расположение 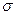 -связей определяет пространственную конфигурацию молекул. Например, молекулы
-связей определяет пространственную конфигурацию молекул. Например, молекулы 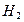 и
и 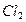 имеют линейное строение (рис.5).
имеют линейное строение (рис.5).
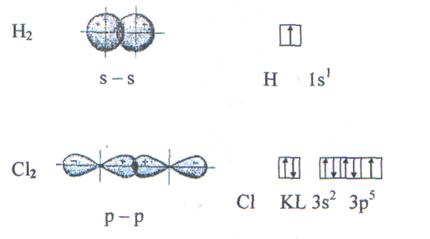
Рис.5. Образование молекул водорода и хлора.
Пи - связь ( -) - это связь, образованная перекрыванием атомных орбиталей по обе стороны линии, соединяющей ядра атомов (рис.4). Например, в молекуле
-) - это связь, образованная перекрыванием атомных орбиталей по обе стороны линии, соединяющей ядра атомов (рис.4). Например, в молекуле  - одна
- одна 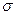 - связь и две
- связь и две  - связи.
- связи.
При наложении  - связи на
- связи на 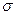 - связь образуется двойная связь ( например, в молекулах
- связь образуется двойная связь ( например, в молекулах 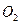 ,
, 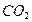 ,
, 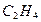 ). Хотяэнергия
). Хотяэнергия  - связи меньше, чем энергия
- связи меньше, чем энергия 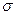 - связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи. При наложении двух
- связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи. При наложении двух  - связей на
- связей на 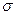 - связь возникает тройная связь, энергия которой выше, а длина связи ниже, чем энергии и длины простой и двойной связей. (см. таблицу 1).
- связь возникает тройная связь, энергия которой выше, а длина связи ниже, чем энергии и длины простой и двойной связей. (см. таблицу 1).
Таблица 1
Энергии 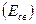 и длины
и длины  некоторых химических связей.
некоторых химических связей.
| Связь | 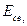 кДж/моль кДж/моль
| 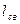 , нм , нм
| Связь | 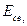 кДж/моль кДж/моль
| 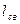 , нм , нм
| |
| H-F | 0,092 | C - C | 0,154 | |||
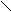  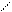  H-Cl H-Cl
| 0,128 | C = C | 0,134 | |||
| H-Br | 0,142 | O = O | 0,121 | |||
| H-I | 0,162 | - C 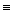 C - C -
| 0,120 | |||
| H-H | 0,074 | C 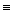 O O
| 0,113 | |||
| H-S | 0,134 | N 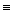 N N
| 0,110 |
Cвязь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется дельта-связью 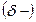 (рис.4).
(рис.4).
Пространственные формулы молекул весьма разнообразны. Так, молекула 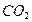 имеет линейную структуру, молекула
имеет линейную структуру, молекула  - тетраэдрическую, молекула
- тетраэдрическую, молекула 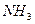 - пирамидальную, молекула
- пирамидальную, молекула 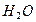 - угловую, молекула
- угловую, молекула 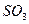 - треугольную.
- треугольную.
Если у атома, вступающего в химическую связь, имеются разные атомные орбитали (s-, p-, d- орбитали), то в процессе образования химической связи происходит гибридизация ( смешение ) атомных орбиталей, т.е.из разных орбиталей образуются одинаковые (эквивалентные) атомные орбитали. Гибридные орбитали образуются у одного атома, имеющего разные орбитали. Причем, гибридизация происходит у орбиталей, имеющих близкие значения энергии.
Форма гибридной орбитали отличается от формы исходных атомных орбиталей (рис.6). В результате химические связи, образованные гибридными орбиталями прочнее, а полученная молекула более устойчива.
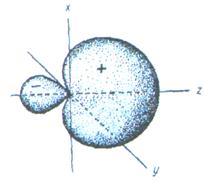
Рис.6. Атомная sp-гибридная орбиталь.
Если в химическую связь вступает атом, у которого на внешней оболочке имеются s- и p- электроны, то у данного атома в процессе образования связи происходит sp-гибридизация атомных орбиталей (рис.7).
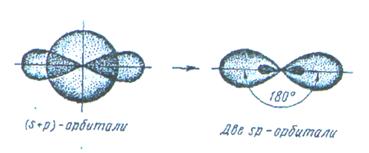
Рис.7. Схема sp - гибридизации.
Например, у атома берриллия sp-гибридизация орбиталей проявляется в молекуле 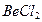 , которая вследствие этого имеет линейную форму:
, которая вследствие этого имеет линейную форму:
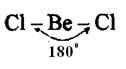
Если у атома на внешней оболочке имеются один s- и два р- электрона, то происходит sp  - гибридизация атомных орбиталей этого атома (рис.8).
- гибридизация атомных орбиталей этого атома (рис.8).
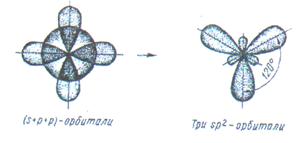
Рис.8. Схема sp 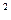 - гибридизации.
- гибридизации.
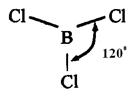
Например, вследствие sp 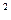 - гибридизации орбиталей атома бора молекула
- гибридизации орбиталей атома бора молекула 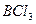 имеет треугольную форму:
имеет треугольную форму:
У атома, имеющего на внешней оболочке один s- и три p- электрона, при химическом взаимодействии происходит sp  - гибридизация (рис. 9).
- гибридизация (рис. 9).
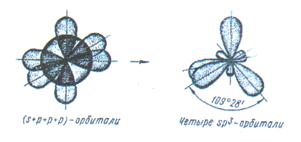
Рис. 9. Схема sp  - гибридизации.
- гибридизации.
Например, вследствие sp  - гибридизации орбиталей атома углерода многие соединения (СН4, CCl4) имеют форму тетраэдра:
- гибридизации орбиталей атома углерода многие соединения (СН4, CCl4) имеют форму тетраэдра:
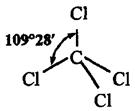
Возможны также более сложные виды гибридизации с участием d- и f - орбиталей атомов, некоторые из них показаны в таблице 2.
Таблица 2
Пространственная конфигурация некоторых соединений.
| Тип гибридизации | Конфигурация | Угол между | Примеры |
| центрального атома | молекулы | связями, град | соединений |
| sp | Линейная | ZnС12,ВеF2 | |
| sp2, dp2, sd2 | Плоская тригональная | ВС13, АlF3 | |
| sp3, sd3 | Тетраэдр | 109°28' | СH4, SiН4 |
| dsp2 | Плоский квадрат | РdВr4, | |
| dsp3 | Тригональная | 90 и 120 | РF5 |
| Бипирамида | |||
| d2 sp3 | Октаэдр | SF6, SbCl 
| |
| d4 sp3 | Додекаэдр | Мо(СN) 
|
Выше были рассмотрены правильные геометрические формы молекул с валентными углами 180°, 120° и 109,5°, 90°. Однако, согласно экспериментальным данным, значительно чаще встречаются молекулы и комплексы с несколько иными значениями валентных углов. Валентные углы в молекулах NНз и Н2О составляют, например, 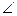 HNH = 107,3° и
HNH = 107,3° и 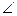 НОН = 104,5° (рис. 10). Рассмотрим влияние несвязывающей электронной пары центрального атома на строение этих молекул.
НОН = 104,5° (рис. 10). Рассмотрим влияние несвязывающей электронной пары центрального атома на строение этих молекул.
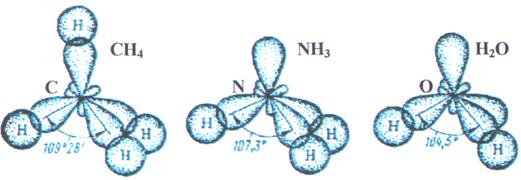
одна несвяз. пара две несвяз. пары
Рис. 10. Перекрывание валентных орбиталей в молекулах CH4, NH3, Н2О.
Согласно теории гибридизации центральные атомы этих молекул образуют химические связи за счет электронов sp3 - гибридных орбиталей. У атома углерода на четыре sp3 - гибридные орбитали приходится четыре электрона:
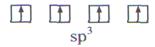 С
С
Это определяет образование четырех связей С - Н и расположение атомов водорода молекулы метана СН4 в вершинах тетраэдра (рис. 10).
У атома азота на четыре sp3 - гибридные орбитали приходится пять электронов:
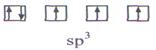 N
N
Следовательно, одна пара электронов оказывается несвязывающей и занимает одну из sp3 -гибридных орбиталей, направленных к вершине тетраэдра (рис. 10). Молекула NHз имеет форму тригональной пирамиды.
У атома кислорода на четыре sp3 - гибридные орбитали приходится шесть электронов:
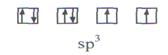 O
O
Теперь уже несвязывающие электронные пары занимают две гибридные sp3 - орбитали. Молекула Н2О имеет угловую форму (рис. 10).
Если ковалентная связь образована одинаковыми атомами (например, Н2, N2, О2), то обобщенные электроны равномерно распределены между ними, т.е. центры тяжести положительных и отрицательных зарядов совпадают. Такая связь называется ковалентной неполярной. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше электроотрицательность у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательностей атомов характеризует полярность связи.
Ковалентная полярная связь образуется в молекулах, атомы которых имеют различную электроотрицательность (например, НС1, SО3, NН3, Н2S). Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома и, соответственно, атом получает заряд, называемый эффективным зарядом атома 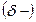 . У второго атома повышается плотность положительного заряда
. У второго атома повышается плотность положительного заряда 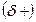 . Вследствие этого молекула становится дипольной, т.е. электрически нейтральной системой, состоящей из двух равных по величине и противоположных по знаку зарядов (+ q и - q), находящихся на некотором расстоянии друг от друга (рис.11). Расстояние между центрами тяжести положительного и отрицательного зарядов называется длиной диполя (l).
. Вследствие этого молекула становится дипольной, т.е. электрически нейтральной системой, состоящей из двух равных по величине и противоположных по знаку зарядов (+ q и - q), находящихся на некотором расстоянии друг от друга (рис.11). Расстояние между центрами тяжести положительного и отрицательного зарядов называется длиной диполя (l).
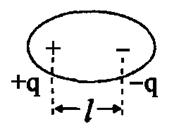
Рис. 11. Образование дипольной молекулы.
Вещества с полярной ковалентной связью количественно характеризуются дипольным моментом (µ). Дипольный момент молекулы определяется как векторная сумма из дипольных моментов отдельных связей и равен произведению величины заряда (q) на длину диполя (l):
µ = q l
Момент диполя имеет единицу измерения кулон на метр (Кл . м) и внесистемную единицу измерения дебай D, равную 3,3 . 10-30 Кл . м.
Дипольный момент даёт возможность определить тип связи, если µ= 0, то связь ковалентная неполярная;если 0 < µ < 4 D, то связь ковалентная полярная; а если 4 < µ < 11 D, то связь ионная.
Дипольный момент определяет геометрию простых молекул. Например, молекула СО2 имеет симметричное линейное строение:
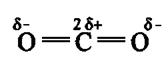
И хотя связи С = О имеют сильно полярный характер, вследствие взаимной компенсации моментов их диполей молекула СО2 в целом неполярна (µ = 0D). Молекула SO2 полярна (µ = 1,61 D) и имеет угловое строение:
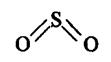
Под действием внешнего электрического поля молекула поляризуется, т.е. в ней происходит перераспределение зарядов, и молекула приобретает новое значение момента диполя. При этом неполярные молекулы могут превратиться в полярные, а полярные становятся ещё более полярными. Иначе говоря, под действием электрического поля в молекулах индуцируется диполь, называемый наведённым или индуцированным. В отличие от постоянных и мгновенных наведённые диполи существуют лишь при действии внешнего электрического поля. После прекращения действия поля, наведённые диполи исчезают.
Метод молекулярных орбиталей рассматривает молекулу как систему с объединенными электронами и ядрами. Согласно методу молекулярных орбиталей электроны в молекулах распределены по молекулярным орбиталям, которые подобно атомным орбиталям характеризуются определенной энергией (энергетическим уровнем) и формой. В отличие от атомных орбиталей молекулярные орбитали охватывают не один атом, а всю молекулу, т.е. являются двух - или многоцентровыми. Таким образом, молекулярная орбиталь - это результат сложения или вычитания атомных орбиталей.
Широко в методе молекулярных орбиталей используется линейная комбинация атомных орбиталей (ЛКАО). При этом соблюдается несколько правил:
1. число молекулярных орбиталей равно общему числу атомных орбиталей;
2. энергия разрыхляющих молекулярных орбиталей оказывается выше, связывающих -ниже энергии исходных атомных орбиталей, а средние энергии приблизительно равны;
3. электроны заполняют молекулярные орбитали, как и атомные орбитали, в порядке возрастания энергии, при этом соблюдается принцип запрета Паули и правило Гунда;
4. прочность связи в методе молекулярных орбиталей пропорциональна степени перекрывания атомных орбиталей.
Если обозначить атомные орбитали атомов - А и В, а молекулярные орбитали - АВ, то согласно ЛКАО
ψАВ = а ψА  в ψВ,
в ψВ,
где ψАВ - волновая функция электрона в молекуле (МО);
а и в коэффициенты, учитывающие долю каждой АО в образовании МО;
ψА и ψВ - волновые функции электронов (АО) соответственно в атомах А и В.
При формировании связывающих молекулярных орбиталей электронная плотность в основном сосредоточена между ядрами, поэтому образование связывающих орбиталей снижает энергию и упрочняет молекулу. Разрыхляющие молекулярные орбитали понижают электронную плотность между ядрами, поэтому они не связывают атомы в молекулу и называются антисвязывающимимолекулярными орбиталями. Молекулярные орбитали, получающиеся при комбинации s - АО, называются σs - МО, при комбинации рх - АО - σх - МО (где х - линия, соединяющая ядра атомов), при комбинации ру - и рz - АО -  у и
у и  z - МО (рис. 12 - 14).
z - МО (рис. 12 - 14).
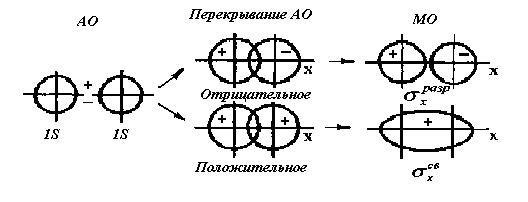
Рис. 12. Схема образования связывающей σ  и разрыхляющей σ
и разрыхляющей σ  молекулярных орбиталей при перекрывании атомных s - орбиталей.
молекулярных орбиталей при перекрывании атомных s - орбиталей.
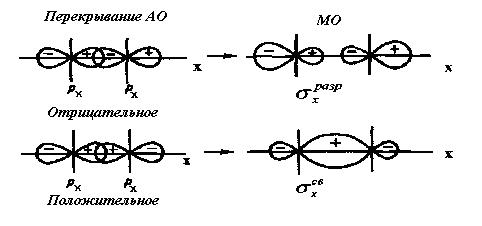
Рис. 13. Схема образования из рх - атомных орбиталей связывающей σ  и разрыхляющей σ
и разрыхляющей σ  орбиталей двухатомной гомоядерной молекулы.
орбиталей двухатомной гомоядерной молекулы.
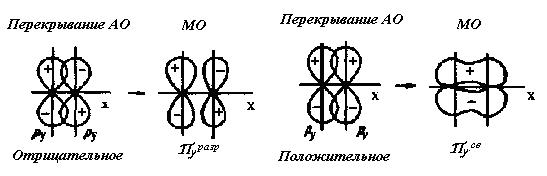
Рис. 14. Схема образования из ру.атомных орбиталей связывающей 
 и разрыхляющей
и разрыхляющей 
 молекулярных орбиталей двухатомной гомоядерной молекулы.
молекулярных орбиталей двухатомной гомоядерной молекулы.
С помощью метода молекулярных орбиталей можно определить порядок связи (n) в молекуле, который равен половине разности электронов на связывающих Nсв и разрыхляющих Nр молекулярных орбиталях:
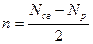
Если Nсв = Nр, то n = 0 и молекула не образуется.
В отличие от метода ВС в методе МО допускается, что химическая
связь может быть образована не только парой, но и одним электроном и соответственно порядок связи может быть не только целым, но и дробным числом: п= 1/2, 1,3/2, 2,5/2, 3...
По возрастанию энергии МО орбитали двухатомных молекул первого периода и начала второго периода (до N2) можно расположить в следующий ряд:
σсв1S < σразр1S < σсв2S < σразр2S <  св2ру=
св2ру=  св2рz < σсв2рх <
св2рz < σсв2рх <  разр2ру =
разр2ру =  разр2рz < σразр2рх
разр2рz < σразр2рх
Молекулярные орбитали двухатомных молекул конца второго периода по возрастанию энергии располагаются в несколько иной ряд:
σсв1S < σразр1S < σсв2s < σразр2S < σсв2рх <  св2ру =
св2ру =  св2рz<
св2рz<  разр2ру =
разр2ру =
=  разр2рz < σразр2рх
разр2рz < σразр2рх
Образование химической связи в молекуле водорода можно представить электронными конфигурациями:
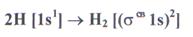
В соответствии с энергетической диаграммой (рис. 14) при образовании связи два 1s - электрона окажутся на σ  молекулярной орбитали, а σ
молекулярной орбитали, а σ  -орбиталь будет незаполненной. Соответствующий порядок связи равен (2-0)/2=1. Молекулярный водород диамагнитен.
-орбиталь будет незаполненной. Соответствующий порядок связи равен (2-0)/2=1. Молекулярный водород диамагнитен.
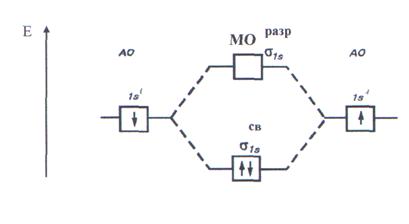
Рис. 15. Энергетическая диаграмма АО атомов водорода и МО молекул
водорода.
При взаимодействии атома и положительно заряженного иона водорода образуется молекулярный ион Н2+:
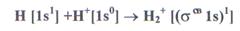
Порядок связи МО равен (1 - 0)/2=0,5, длина связи у молекулы Н2 меньше, а энергия связи больше, чем у молекулярного иона Н2+.
Молекула Нe2 не образуется, порядок связи равен 0, т.к. при образовании связи по два 1s - электрона окажутся и на разрыхляющей, и на связывающей орбиталях.
Электронные конфигурации и некоторые экспериментальные данные двухатомных молекул элементов второго периода представлены в таблице 3.
Таблица 3
Электронные конфигурации и некоторые экспериментальные данные двухатомных молекул второго периода.
| MO | B2 | C2 | N2 | O2 | F2 | Ne+Ne |
| σразр2рх | - | - | - | - | - | 
|
 разр2ру, разр2ру,  разр2рz разр2рz
| - - | - - | - - | 
|  
|  
|
| σсв2рх | - | - | 
| 
| 
| 
|
 св2ру, св2ру,  св2рz св2рz
|  
|  
|  
|  
|  
|  
|
| σразр2S | 
| 
| 
| 
| 
| 
|
| σсв2s | 
| 
| 
| 
| 
| 
|
| Порядок связи | ||||||
| Длина связи, м | 0, 159 | 0,131 | 0,110 | 0,121 | 0,142 | - |
| Энергия диссоциации, кДж/моль | Молеку - ла не образу – ется | |||||
| Магнитные свойства ПМ и ДМ – (парамагнитные и диамагнитные вещества) | ПМ | ДМ | ДМ | ПМ | ДМ |
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1281; Нарушение авторских прав?; Мы поможем в написании вашей работы!