
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика. Пример 1. При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОС13 и хлороводород
|
|
|
|
Пример 1. При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОС13 и хлороводород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции.
Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp, равные изменению энтальпии системы ∆Н. Значение ∆Н приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно.
Если в результате реакции выделяется теплота, то ∆Н < 0. Считывая сказанное, составляем термохимическое уравнение данной в примере реакции:
РС15(к) + Н2О(г) = РОСl 3(ж) + 2НС1(г); ∆Нхр = -111,4 кДж
Таблица 3
Стандартные теплоты (энтальпии) образования  некоторых веществ
некоторых веществ
| Вещество | Состо- яние | ∆Н 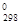 , кДж/моль , кДж/моль
| Вещество | Состо-яние | ∆Н 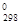 , кДж/моль , кДж/моль
|
| С2Н2 СS2 NО С6Н6 С2Н4 Н2S NН3 СН4 С2Н6 НСl | г г г г г г г г г г | +226,75 +115,28 +90,37 +82,93 +52,28 -20,15 -46,19 -74,85 -84,62 -92,31 | СО СН3ОН С2Н5ОН Н2О Н2О NН4Сl СО2 Fе2О3 ТiО2 Са(ОН)2 Аl2О3 | г г г г ж к г к к к к | -110,52 -201,17 -235,31 -241,83 -285,84 -315,39 -393,51 -822,10 -943,90 -986,50 -1669,80 |
Пример 2. Реакция горения этана выражается термохимическим уравнением С2Н6(г) + 3 ½ О2 = 2 СО2(г) + 3 Н2О(ж); Нхр = -1559,87 кДж.
Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж) (см. табл. 5).
Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Обычно теплоту образования относят к стандартному состоянию, т.е. 25 оС (298 К) и 1,013∙105 Па и обозначают через ∆Н 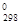 . Так как тепловой эффект с температурой изменяется незначительно, то в дальнейшем индексы опускаются и тепловой эффект обозначается через ∆Н. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
. Так как тепловой эффект с температурой изменяется незначительно, то в дальнейшем индексы опускаются и тепловой эффект обозначается через ∆Н. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
2С (графит) + ЗН2(г) - С2Н6(г); ∆Н=?
исходя из следующих данных:
а) С2Н6(г) + 3'/2О2(г) = 2СО2(г) + ЗН2О(ж); ∆Н= -1559,87 кДж;
б) С (графит) + О2(г) = СО2(г); ∆Н = -393,51 кДж;
в) Н2(г) + ½ O2 = Н2О(ж); ∆Н = - 285,84 кДж.
На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) — на 3, а затем сумму этих уравнений вычислить из уравнения (а):
С2Н6 + 372О2 - 2C - 2О2-ЗН2 -3/2О2 = 2СО2 + ЗН2О -2СО2 - ЗН2О
∆Н = -1559,87 -2(-393,51)-3(-285,84) = +84,67 кДж;
∆Н = -1559,87 + 787,02 + 857,52; С2Н6 = 2С + ЗН2; ∆Н= + 84,67 кДж.
Так как теплота образования равна теплоте разложения с обратным знаком, то ∆Н  (г) = -84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
(г) = -84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
∆Нх р = 2∆НСО2 + З∆НН2О - ∆НС2н6 - 3 ½ ∆НО2
Учитывая, что теплоты образования простых веществ условно приняты равными нулю ∆Нс2н6 = 2∆НСО  + З∆НН
+ З∆НН  О - ∆Нх р
О - ∆Нх р
∆Нс2н6 = 2(-393,51) + 3(-285,84) + 1559,87 = -84,67;
то ∆Н 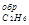 (г) = -84,67 кДж
(г) = -84,67 кДж
Пример 3. Реакция горения этилового спирта выражается термохимическим уравнением
С2Н5ОН(ж) + ЗО2(г) = 2СО2(г) + ЗН2О(ж); ∆Н=?
Вычислите тепловой эффект реакции, если известно, что молярная теплота парообразования С2Н5ОН(ж) равна +42,36 кДж, а теплоты образования С2Н5ОН(г), СО2(г), Н2О(ж) см. табл. 5.
Решение. Для определения ∆Н реакции необходимо знать теплоту образования С2Н5ОН(ж). Последнюю находим из данных:
С2Н5ОН(ж) = С2Н5ОН(г); ∆Н= +42,36 кДж +42,36=-235,31-∆НС2Н5ОН (ж);
∆НС2Н5ОН (ж) = -235,31 - 42,36 = -277,67 кДж.
Вычисляем реакции, применяя следствия из закона Гесса:
∆Нхр = 2(-393,51) + 3(-285,84) + 277,67 = -1366,87 кДж.
Пример 4. В каком состоянии энтропия 1 моль вещества больше при одинаковой температуре: в кристаллическом или парообразном?
Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше объема 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 5. Прямая или обратная реакция будет протекать при стандартных условиях в системе СН4(г) + СО2 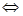 2СО(г) + 2Н2(г)
2СО(г) + 2Н2(г)
Решение. Вычислим ∆G0298 прямой реакции. Значения ∆G0298 соответствующих веществ приведены в таблице 4. Зная, что ∆G есть функция состояния и что ∆G для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим ∆G0298 процесса: ∆G0298 = 2(-137,27) + 2(0) - (-50,79 - 394,38) = + 170,63 кДж.
То что ∆G0298 > 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов, равном 1,013 ∙105 Па (760 мм рт. ст. = 1 атм).
Таблица 4
Стандартная энергия Гиббса образования  некоторых веществ
некоторых веществ
| Вещество | Состояние |  ,
кДж/моль ,
кДж/моль
| Вещество | Состояние |  кДж/моль
кДж/моль
|
| ВаSО4 | К | -1138,8 | FeO | К | -244,3 |
| СаСО3 | К | -1128,75 | H2O | Ж | -237,19 |
| Fе3О4 | К | -1014,2 | H2O | Г | -228,59 |
| ВеСО3 | К | -944,75 | PbO2 | К | -219,0 |
| СаО | К | -604,2 | CO | Г | -137,27 |
| ВеО | К | -581,61 | CH4 | Г | -50,79 |
| NаF | К | -541,0 | NO2 | Г | +51,84 |
| ВаО | К | -528,4 | NO | Г | +86,69 |
| СО2 | Г | -394,38 | C2H2 | Г | +209,20 |
| NaCl | К | -384,03 | |||
| ZnO | К | -318,2 |
Таблица 5
Стандартные абсолютные энтропии 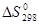 некоторых веществ
некоторых веществ
| Вещество | Состоя ние | 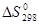 Дж/
(моль∙К) Дж/
(моль∙К)
| Вещество | Состоя ние | 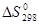 Дж/(моль∙К) Дж/(моль∙К)
|
| С | алмаз | 2.44 | H2O | Г | 188,72 |
| С | Графит | 5.69 | N2 | Г | 191,49 |
| Fe | К | 27.2 | NH3 | Г | 192,50 |
| Ti | К | 30.7 | CO | Г | 197,91 |
| S | Ромб | 31.9 | C2H2 | Г | 200,82 |
| TiO2 | К | 50.3 | O2 | Г | 205,03 |
| FeO | К | 54.0 | H2S | Г | 205,64 |
| H2O | Ж | 69.94 | NO | Г | 210,20 |
| Fe2O3 | К | 89.96 | CO2 | Г | 213,65 |
| NH4Cl | К | 94.5 | C2H4 | Г | 219,45 |
| CH3OH | Ж | 126.8 | Cl2 | Г | 222,95 |
| H2 | Г | 130.59 | NO2 | Г | 240,46 |
| Fe3O4 | К | 146.4 | PCl3 | Г | 311,66 |
| CH4 | Г | 186.19 | PCl5 | Г | 352,71 |
| HCl | Г | 186.69 |
Пример 6. На основании стандартных теплот образования (см. табл. 3) и абсолютных стандартных энтропии веществ (табл. 5) вычислите ∆S0298 реакции, протекающей по уравнению СО(г) + Н2О(ж) = СО2(г) + Н2(г)
Решение. ∆G0 = ∆Н - Т∆S0; ∆Н и ∆S — функции состояния, поэтому
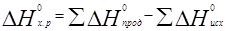
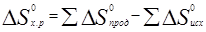
∆Н 0х.р. = (-393,51+0) – (-110,52-285,84) = +2,85 кДж
∆S 0х.р. =(213.65 + 130.59) – (197.91 + 69.94) = +79.39 = 0.07639кДж/(моль∙К)
∆G0 = +2,85 – 298 ∙ 0,07639 = - 19,91 кДж.
Пример 7. Реакция восстановления Fe2O3 водородом протекает по уравнению Fe2O3(к)+ 3H2(г) = 2Fe(к) + ЗН2О(г); ∆Н= +96,61 кДж
Возможна ли эта реакция при стандартных условиях, если изменение энтропии ∆S = 0,1387 кДж/(моль∙К)? При какой температуре начнется восстановление Fe2О3?
Решение. Вычисляем ∆G0 реакции: ∆G =∆H-T∆S = 96,61 -298 ∙ 0,1387 = +55,28 кДж.
Так как ∆G > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой ∆G =0:
∆Н = Т∆S; 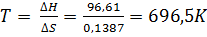
Следовательно, при температуре ≈ 696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
Пример 8. Вычислите ∆Н°, ∆S и ∆G0т реакции, протекающей по уравнению Fe2O3(к) + ЗС = 2Fe + ЗСО. Возможна ли реакция восстановления Fe2O3 углеродом при 500 и 1000 К?
Решение. ∆Н 0х.р. и ∆S 0х.р. находим из соотношений (1) и (2):
∆Н 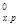 = [3(-110.52)+2∙0]-[-822.10+3∙0]
= [3(-110.52)+2∙0]-[-822.10+3∙0]
Энергию Гиббса при соответствующих температурах находим из соотношения
∆G500= 490,54 -500  = +219,99кДж
= +219,99кДж
∆G1000 = 490,54 - 1000  = -50.56кДж
= -50.56кДж
Так как ∆G500 >0, а ∆G1000 <0, то восстановление Fe2O3 возможно при 1000 К и невозможно при 500К.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1057; Нарушение авторских прав?; Мы поможем в написании вашей работы!