
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы Коновалова. Азеотропные смеси
|
|
|
|
Соотношения между составами равновесных растворов и их паров, а также общим давлением пара над раствором были установлены Д.П. Коноваловым в 1881 году и носят название законов Коновалова.
Первый закон Коновалова гласит: общее давление пара над раствором растёт с ростом доли в растворе легколетучего компонента.
На этом явлении основана фракционная перегонка (ректификация), позволяющая разделить смесь взаимнорастворимых жидкостей.
Второй закон Коновалова касается более частных случаев. Для некоторых реальных растворов с большими отклонениями от закона Рауля на кривых «общее давление пара – состав» могут появляться минимумы или максимумы.
Второй закон Коновалова можно сформулировать следующим образом:
в точках экстремумов на кривых общего давления насыщенного пара (или температур кипения) составы пара и сосуществующего с ним в равновесии жидкого раствора совпадают.
Диаграммы состояния бинарных систем с максимумом на кривой давления пара и минимумом на кривой температур кипения представлены на рис. 6.
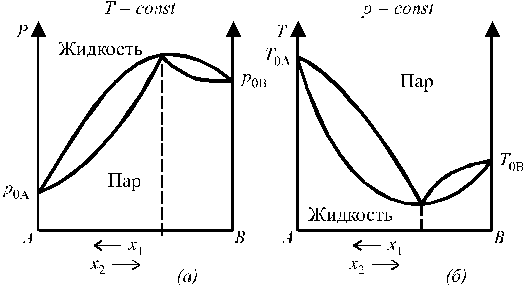 |
Рис. 6. Диаграммы состояния бинарных систем с максимумом
на кривой давления пара (а) и минимумом на кривой температур кипения (б).
Растворы, у которых состав жидкой фазы и пара одинаковы, называются азеотропными, или нераздельнокипящими.
Путём перегонки азеотропные растворы не разделяются (составы фаз равны). Но их можно разделить следующими методами:
-путём химического связывания одного из компонентов;
-путем добавления в систему третьего компонента;
Простая перегонка жидких смесей.
Для разделения смесей жидкостей на практике часто используют метод перегонки, который основан на различии в составах пара и жидкости, из которой пар получен.
Рассмотрим диаграмму кипения двухкомпонентной системы, состоящей из двух неограниченно смешивающихся жидкостей А и В.
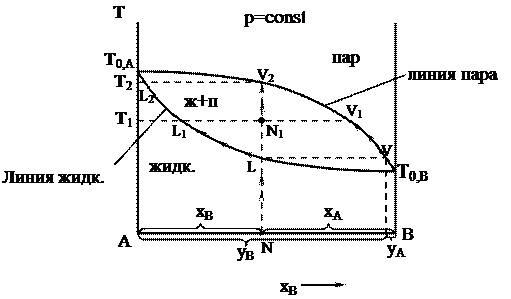
T0,A > T0,B
Возьмем жидкость определенного состава, характеризующегося точкой N, и начнем её постепенно нагревать при p = const. Этому процессу соответствует перемещение фигуративной точки по вертикальной прямой NL. В фазовой точке L (от liquid – жидкость), лежащей на кривой жидкости, начинается переход жидкости в пар. Здесь видно, что уВ > хВ (компонента В в паре больше, чем в жидкости), т.е. в соответствии с первым законом Коновалова, пар, по сравнению с жидкостью, обогащен более летучим компонентом В. При дальнейшем повышении температуры фигуративная точка суммарного состава всей смеси будет подниматься вверх по той же вертикали, а фазовые точки пара и жидкости смещаются соответственно по кривым пара и жидкости. При этом количество жидкости уменьшается, а количество пара - возрастает (в соответствии с правилом рычага). При температуре Т1 состав пара характеризуется точкой V1, а состав жидкости - точкой L1, а суммарный состав смеси - фигуративной точкой N1, лежащей на ноде L1N1V1. При температуре Т2 жидкость полностью переходит в пар состав пара соответствует точке V2, т.е. он имеет такой же состав, как и состав исходной жидкости (точка N). При дальнейшем повышении температуры (выше Т2) фазовое состояние системы не изменяется. В результате простой перегонки в остатке можно получить некоторое количество (обычно небольшое) почти чистого труднолетучего компонента А, а хорошо испаряющийся компонент (В) в результате простой перегонки в чистом виде не выделяется.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1099; Нарушение авторских прав?; Мы поможем в написании вашей работы!