
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: Жидкое и твердое состояния вещества. 2 страница
|
|
|
|
где n – число молекул газа в единице объема (концентрация) на высоте h, n0 – концентрация молекул газа на нулевом уровне (уровне земли)
Больцман показал, что полученное распределение применимо к идеальному газу, находящемуся в любом силовом поле.
2. Результаты экспериментальных и теоретических исследований позволили уже в девятнадцатом веке сформулировать основные положения молекулярно-кинетической теории для газов:
· газ состоит из молекул (мельчайших частиц, размеры которых порядка 10-10 м);
· молекулы газа находятся в непрерывном хаотическом движении;
· молекулы сталкиваются друг с другом. Столкновения бывают упругими (низкие температуры) и неупругими (высокие температуры);
· в промежутке между соударениями молекулы движутся прямолинейно;
· молекулы на малых расстояниях отталкиваются, а на больших притягиваются друг к другу.
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. В модели идеального газа предполагается следующее: молекулы обладают пренебрежимо малым объемом по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударениях молекул друг с другом и со стенками сосуда действуют силы отталкивания.
При упругом столкновении молекулы со стенкой сосуда проекция vх вектора скорости на ось ОХ, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю (см.рис).
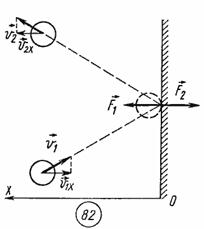
Поэтому в результате столкновения молекулы со стенкой проекция ее импульса на ось ОХ изменяется от mv1х = - mvх до mv2х = mvх. Изменение импульса молекулы показывает, что на нее при столкновении действует сила 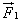 , направленная от стенки. Изменение импульса молекулы равно импульсу силы:
, направленная от стенки. Изменение импульса молекулы равно импульсу силы:
 .
.
Во время столкновения молекула действует на стенку с силой 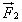 , равной по третьему закону Ньютона силе
, равной по третьему закону Ньютона силе 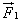 по модулю и направленной противоположно.
по модулю и направленной противоположно.
Молекул газа очень много, и удары их о стенку следуют один за другим с очень большой частотой. Среднее значение геометрической суммы сил, действующих со стороны отдельных молекул при их столкновениях со стенкой сосуда, и является силой давления газа. Давление газа равно отношению модуля силы давления 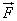 к площади стенки S:
к площади стенки S:
 .
.
На основе использования основных положений молекулярно-кинетической теории было получено уравнение, которое позволяет вычислить давление газа, если известны масса m молекулы газа, среднее значение квадрата скорости молекул 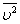 и концентрация n молекул:
и концентрация n молекул:
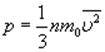
Среднее значение кинетической энергии молекул идеального газа
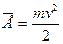 , получим
, получим  .
.
Давление идеального газа равно двум третям средней кинетической энергии движения молекул, содержащихся в единице объема.
Опыт показывает, что давление и температура газа связаны, поэтому английским физиком Кельвином была введена абсолютная температура Т как мера средней энергии движения молекул вещества:
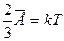
Здесь k - постоянная Больцмана, k = 1,38*10-23 Дж/К. За ноль абсолютной температуры принята такая температура по шкале Кельвина, при которой прекращается всякое движение молекул вещества, т.е. 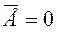 .
.
Связь температур, измеряемых в шкале Кельвина Т и шкале Цельсия t, имеет вид
Т = t + 273.
В результате было получено выражение, связывающее давление и температуру идеального газа
p= nkT,
которое называется основным уравнением молекулярно-кинетической теории газа.
В результате преобразования этого выражения было получено уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
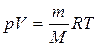 ,
,
где универсальная газовая постоянная R = 8,31 Дж/(моль·К), М - молярная масса газа, m – масса газа, V – объем газа.
Основной закон молекулярно-кинетической теории позволил рассчитать среднюю длину свободного пробега молекул газа между соударениями
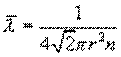
r– размер молекулы, n – число молекул в единице объема газа.
В воздухе при нормальных условиях (давление 1 атм, температура 273 К) средняя длина свободного пробега молекулы составляет порядка 0,6 ·10  м, при этом в единице объема газа каждую секунду совершается порядка 8,6·10
м, при этом в единице объема газа каждую секунду совершается порядка 8,6·10 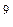 столкновений молекул.
столкновений молекул.
3. Молекулы можно рассматривать как системы материальных точек (атомов) совершающих как поступательное, так и вращательное движения. При исследовании движения тела необходимо знать его положение относительно выбранной системы координат. Для этого вводится понятие о степенях свободы тела. Число независимых координат, которые полностью определяют положение тела в пространстве, называется числом степеней свободы тела.
При движении точки по прямой линии для оценки ее положения необходимо знать одну координату, т.е. точка имеет одну степень свободы. Если точка движения по плоскости, ее положение характеризуется двумя координатами; при этом точка обладает двумя степенями свободы. Положение точки в пространстве определяется 3 координатами. Число степеней свободы обычно обозначают буквой i. Молекулы, которые состоят из обычного атома, считаются материальными точками и имеют три степени свободы (аргон, гелий).
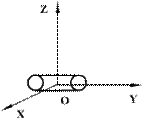
Двухатомные жесткие молекулы, например молекулы водорода, азота и др., обладают пятью степенями свободы: они имеют 3 степени свободы поступательного движения и 2 степени свободы вращения вокруг осей ОХ и OZ (см.рис.). Вращением вокруг оси OY можно пренебречь, т.к. момент инерции ее относительно этой оси пренебрежимо мал. Поэтому вклад энергии вращательного движения вокруг оси OY в суммарную энергию двухатомной молекулы можно не учитывать.
Молекулы, состоящие из трех и более жестко связанных атомов, не лежащих на одной прямой, имеют число степеней свободы i = 6: три степени свободы поступательного движения и 3 степени свободы вращения вокруг осей ОХ, OY и OZ.
В случае, если расстояние между атомами может изменяться (атомы совершают колебания у положения равновесия), появляются дополнительные степени свободы. Согласно молекулярно-кинетической теории газов движение молекул носит беспорядочный характер; эта беспорядочность относится ко всем видам движения молекулы. Ни один из видов движения не имеет преимущества перед другим. При статистическом равновесии движений энергия в среднем распределяется равномерно между всеми видами движения. Закон равномерного распределения энергии по степеням свободы молекул можно сформулировать следующим образом: статистически в среднем на каждую степень свободы молекул приходится одинаковая энергия.
 . Поступательное движение молекул характеризуется средней кинетической энергией, равной
. Поступательное движение молекул характеризуется средней кинетической энергией, равной
Так как поступательному движению соответствует 3 степени свободы, то в среднем на одну степень свободы движения молекул приходится энергия
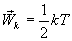
В однородном газе, молекулы которого имеют любое число степеней свободы i, каждая молекула в среднем обладает энергией движения, равной
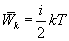
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией хаотического (теплового) движения всех его молекул.
Так как в одном моле любого вещества содержится NА (число Авогадро
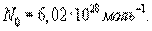 ) молекул, то внутренняя энергия одного моля газа будет
) молекул, то внутренняя энергия одного моля газа будет

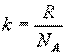 Учитывая, что получим
Учитывая, что получим 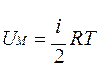 , здесь R=8,31 Дж/(моль·К) – универсальная газовая постоянная.
, здесь R=8,31 Дж/(моль·К) – универсальная газовая постоянная.
Для любой массы m газа с молярной массой М, т.е. для любого числа молей формула для внутренней энергии имеет вид

Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю.
4. Беспорядочное тепловое движение молекул, непрерывные столкновения между ними приводят к тому, что молекулы, хотя и сравнительно медленно, перемещаются из одной точки пространства в другую. В результате столкновения изменяются величины и направления скоростей молекул, что приводит к передаче импульса и энергии. По этой причине в газовой среде, если рассматривать бесконечно малые объемы отдельных участков среды, самопроизвольно возникают флуктуации плотности (концентрации), температуры и давления газа, которые мгновенно исчезают. Если данные неоднородности вызваны посторонним источником и носят постоянный характер, то хаотическое движение молекул стремится ликвидировать эти неоднородности. При этом в газе возникают особые процессы, которые носят название явлений переноса. К ним относятся диффузия, теплопроводность и внутреннее трение.
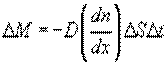 Диффузия. Если в локальном объеме распределена примесь другого газа (или увеличена плотность данного газа), то хаотическое движение молекул будет способствовать выравниванию концентрации газовых молекул. Процесс выравнивания концентрации газовых молекул называется диффузией. Наблюдения показывают, что в процессе диффузии через площадь поверхности
Диффузия. Если в локальном объеме распределена примесь другого газа (или увеличена плотность данного газа), то хаотическое движение молекул будет способствовать выравниванию концентрации газовых молекул. Процесс выравнивания концентрации газовых молекул называется диффузией. Наблюдения показывают, что в процессе диффузии через площадь поверхности  , расположенную нормально оси, вдоль которой происходит изменение концентрации вещества за время
, расположенную нормально оси, вдоль которой происходит изменение концентрации вещества за время  , переносится масса вещества
, переносится масса вещества 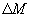 , пропорциональная градиенту концентрации
, пропорциональная градиенту концентрации 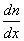 , площади
, площади 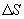 и времени
и времени 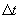
Это уравнение выражает закон Фика. Величина D называется коэффициентом диффузии. Знак минус означает, что масса переносится в сторону убывания концентрации. С точки зрения молекулярно-кинетической теории

Таким образом, коэффициент диффузии определяется средней длиной свободного пробега 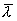 и средней арифметической скоростью
и средней арифметической скоростью  молекул.
молекул.
Теплопроводность. В случае неодинаковых температур в различных частях газа те молекулы, которые находятся в более теплых областях, в среднем обладают большей кинетической энергией, чем молекулы в более холодных областях. И здесь молекулярное движение сопровождается суммарным переносом энергии в направлении более холодных частей газа, вследствие чего происходит выравнивание температуры. Этот процесс называется теплопроводностью. Явление теплопроводности заключается в переносе теплоты  от более горячего слоя с температурой
от более горячего слоя с температурой 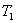 к более холодному, температура которого
к более холодному, температура которого 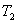 , Закон теплопроводности был сформулирован Фурье: теплота
, Закон теплопроводности был сформулирован Фурье: теплота  переносимая через элемент площади
переносимая через элемент площади 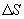 за время
за время 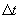 , пропорциональна градиенту температуры
, пропорциональна градиенту температуры 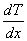 , площади
, площади 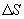 и времени
и времени 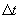 :
:
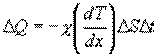
где χ - коэффициент теплопроводности, он зависит от среднеарифметической скорости молекул и плотности газа ( - удельная теплоемкость газа):
- удельная теплоемкость газа):
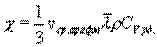
Внутреннее трение. Если два соприкасающихся слоя движутся с различными скоростями, то может происходить выравнивание скоростей слоев газов. В среднем импульсы молекул таких слоев различны - молекулы более быстрых слоев имеют большие значения импульсов. Переход молекул из быстрых слоев в более медленный сопровождается переносом импульса упорядоченного движения. Противоположное по характеру действие оказывают молекулы медленного слоя, перешедшие в быстрый слой, - в этом слое возникают тормозящие силы. Суммарный эффект при этом - выравнивание скоростей слоев. Это явление называется внутренним трением. При этом закон внутреннего трения гласит: сила вязкости F пропорциональна градиенту скорости 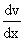 и площади S соприкасающихся слоев:
и площади S соприкасающихся слоев:
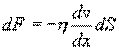
где η - коэффициент внутреннего трения (динамическая вязкость). С точки зрения молекулярно-кинетической теории
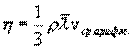
Лекция 8
Тема: Законы термодинамики
Вопросы: 1) Первый закон термодинамики
2) Применение первого закона термодинамики к газовым
процессам
3) Второй закон термодинамики
4) Статистический смысл энтропии
5) Круговые процессы. Цикл Карно
1. Термодинамическое состояние тела (например, газа) характеризуется его массой m, молярной массой М, давлением P, объемом V, температурой T. Все эти величины называются термодинамическими параметрами тела. Однако, такие параметры, как P, V, T, имеют смысл только тогда, когда тело находится, хотя бы приближенно, в так называемом состоянии термодинамического равновесия. Так называется состояние, в котором все термодинамические параметры остаются со временем постоянными. Не имеет смысла, например, говорить о температуре газа до тех пор, пока быстрые молекулы у горячей стенки сосуда, вследствие ряда столкновений с другими, не приобретут скоростей порядка средней скорости остальных молекул, иначе говоря, пока система не придет в состояние равновесия. В состоянии т.д.р. для каждого вещества термодинамические параметры связаны между собой уравнением состояния.
Рассмотрим газ, находящийся в цилиндре с поршнем, позволяющем менять объем газа (см. рис).

Цилиндр контактирует с нагревателем, который может сообщать газу тепло. Пусть на поршень оказывается внешнее давление, величина которого может быть любой.
Все процессы, которые будем рассматривать ниже, будут квазистатическими, т.е. медленными настолько, чтобы можно было считать, что в каждый момент газ находится в состоянии т.д.р. Если очень быстро сжать газ, то давление его у поршня окажется на какой-то момент больше, чем в стальном объеме, и тогда нельзя будет говорить о давлении газа вообще. Такой процесс не является квазистатическим. Приближенно квазистатическими являются и процессы, достаточно быстрые с технической точки зрения, например процессы, происходящих в цилиндрах двигателя автомашины во время работы мотора (оказывается, для приближенной квазистатичности требуется, чтобы скорость поршня была мала по сравнению со скоростью звука в газе).
Работа над газом выполняется внешними силами при его сжатии. Работа самого газа выполняется при его расширении. Пусть газ расширяется так, что поршень поднимается на величину dx. Тогда газ выполнит работу dA=Fdx. Так как P=F/S (S – площадь поршня), то получим dA= P S dx = PdV/
Эта величина называется элементарной работой газа. Работа при расширении газа от объема V1 до V2 будет равна
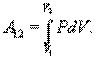
Если по одной оси отложить объем газа, по другой – его давление (плоскость P – V), то работа будет изображаться площадью под кривой P(V) (рис.9.3).
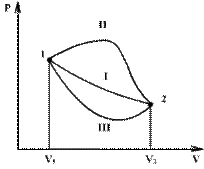
Процесс расширения от объема V1 до объема V2 может происходить различным образом: например, можно при этом изолировать газ от нагревателя или, наоборот, нагревать газ и т.д. Иначе говоря, при перемещении из точки 1 в точку 2 в газе могут происходить различные процессы, даже если зафиксировано начальное и конечное состояния. В каждом процессе работа будет иметь свое значение, так как площадь под кривой процесса будет различной (кривые I, II, и III на рис/). Таким образом, выполняемая газом работа зависит от процесса, который с ним происходит.
Работа положительна, если она выполняется газом, и отрицательна, если внешние силы выполняют ее над газом.
Первый закон термодинамики: теплота, сообщаемая системе, расходуется на изменение внутренней энергии системы и на совершение системой работы против внешних сил:
ΔQ=ΔU+ΔA
Первый закон термодинамики представляет собой закон сохранения энергии.
Под внутренней энергией (U) понимается вся энергия системы за исключением механической энергии системы как целого. Сюда входит кинетическая энергия поступательного движения ее молекул, потенциальная энергия их взаимодействия между собой, энергия возбуждения колебаний и вращений молекул, то есть те виды энергии системы, которые могут меняться в термодинамических процессах. Внутренняя энергия идеального газа складывается только из кинетической энергии поступательного и вращательного движения его молекул (взаимодействие молекул незначительно).
 В термодинамике для характеристики тепловых свойств тел используется понятие теплоемкости. Теплоемкость тела - количество теплоты необходимое для нагревания тела на один Кельвин
В термодинамике для характеристики тепловых свойств тел используется понятие теплоемкости. Теплоемкость тела - количество теплоты необходимое для нагревания тела на один Кельвин
Удельной теплоемкостью называется величина, числено равная теплоте, которую надо сообщить единице массы тела для повышения его температуры на один Кельвин:

Отсюда можно определить количество теплоты, необходимое для нагревания вещества, массы m: ΔQ = cmΔT
Молярная теплоемкость - количество тепла необходимое для нагревания одного моля вещества на один Кельвин

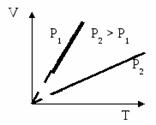
2. Изобарный процесс протекает при постоянном давлении (Р = const), например, при нагревании газа в цилиндре под свободно перемещающимся поршнем.
Из уравнения состояния идеального газа следует, что при р = const, m = const, M = const
V / T = const
Графики, отображающие этот процесс, называют изобарами (см.рис.)
Работа системы при изменении объема от V1 до V2 определяется по площади под графиков в координатах P-V

А= Р(V2 - V1)
Следовательно, теплота, переданная газу при изобарическом процессе, затрачивается на увеличение его внутренней энергии и совершение работы:
ΔQ=ΔU+ рΔ V
Изохорный процесс протекает при постоянном объеме (V = const), например, при нагревании газа в закрытом сосуде. Из уравнения состояния идеального газа следует, что при V = const, m = const, M = const
Р / T = const
Графики, отображающие этот процесс, называют изохорами (см.рис.).

При изохорическом процессе работа не совершается (площадь под графиком в координатах P-V равна 0).

А= рΔ V =0 и первое начало термодинамики приобретает вид: ΔQ=ΔU,
т.е. при изохорическом процессе вся подводимая к газу теплота затрачивается на увеличение внутренней энергии системы.
Изотермический процесс протекает при постоянной температуре (Т = const). Из уравнения состояния идеального газа следует, что при Т = const, m=const, M = const
P·V = const
Кривые, отображающие этот процесс, называют изотермами (см. рис.)
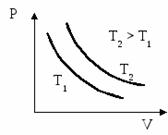
При изотермическом процессе (Т= const) ΔT=0 и изменение внутренней энергии ΔU=0. Согласно первому закону термодинамики теплота, передаваемая газу, полностью затрачивается на внешнюю работу: ΔQ = ΔA
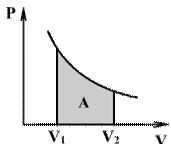
Работа системы численно равны площади под графиком процесса в координатах P-V Аналитическое выражение для работы следующие:
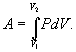
Определим из уравнения Менделеева – Клапейрона Р:
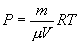
и подставим в уравнение работы
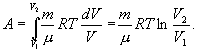
Адиабатический процесс - это такое изменение состояний газа, при котором он не отдает и не поглощает извне теплоты. Следовательно, адиабатический процесс характеризуется отсутствием теплообмена газа с окружающей средой. Адиабатическими можно считать быстро протекающие процессы.
Так как передачи теплоты при адиабатическом процессе не происходит, то ΔQ и уравнение I начала термодинамики принимает вид
ΔU+ΔA = 0 или ΔA = -ΔU. т.е. внешняя работа газа может производиться вследствие изменения его внутренней энергии.
Адиабатное расширение газа (ΔV>0) сопровождается положительной внешней работой, но при этом внутренняя энергия уменьшается и газ охлаждается (ΔT<0).
Сжатие газа (ΔV<0) совершается при воздействии внешних сил; в этом случае работа отрицательна и ΔT>0. Адиабатное сжатие газа сопровождается его нагреванием.
Адиабатический процесс описывается уравнением Пуассона 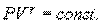
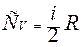
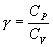
где СV – молярная теплоемкость газа при постоянном объеме
Ср –молярная теплоемкость газа при постоянном давлении, Ср = СV+R.
Линию, изображающую адиабатический процесс в диаграмме состояния, называют адиабатой. На рисунке ниже сплошной линией показан вид адиабаты в (P-V) диаграмме. Для сравнения в том же рисунке пунктирной линией изображена изотерма, соответствующая температуре газа в начальном состоянии. Так как для любого идеального газа показатель адиабаты γ>1, то в (P-V) диаграмме адиабата всегда идет круче, чем изотерма. Объясняется это тем, что при адиабатическом сжатии увеличение давления обусловлено не только уменьшением объема газа, как при изотермическом сжатии, то также еще и увеличения температуры. При адиабатическом расширении температура газа уменьшается, поэтому давление газа падает быстрее, чем при изотермическом расширении.
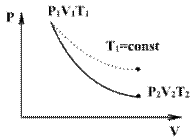
Работа, совершаемая газом в адиабатическом процессе
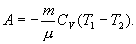

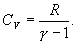
Поэтому
3. Обратимым процессом называют такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. После протекания обратимого процесса в одном, а затем в обратном направлении и возвращение системы в первоначальное состояние в окружающих телах не должно оставаться никаких изменений. Например шарик на пружине в вакууме колеблется бесконечно долго.
В том случае, когда после завершения прямого и обратного процессов система вернулась в первоначальное состояние и в окружающей среде остались изменения, процесс является необратимым. Очевидно, что все процессы в природе необратимые.
Выражая всеобщий закон сохранения и превращения энергии, первый закон термодинамики не позволяет определить направление протекания процесса. В самом деле, процесс самопроизвольной передачи энергии в форме теплоты от холодного тела к горячему ни в какой мере не противоречит первому закону термодинамики. Однако при опускании раскаленного куска железа в холодную воду никогда не наблюдается явление дальнейшего нагревания железа за счет соответствующего охлаждения воды. Далее, первый закон не исключает возможности такого процесса, единственным результатом которого было бы превращение теплоты, полученной от нагревателя в эквивалентную ей работу. Так, например основываясь на первом законе можно было бы попытаться построить периодически действующий двигатель, совершающий работу за счет одного источника тепла (например за счет внутренней энергии океана). Такой двигатель называется вечным двигателем второго рода. Обобщение огромного экспериментального материала привело к выводу о невозможности построения вечного двигателя второго рода. Этот вывод получил название второго начала термодинамики.
Существует ряд различных по форме, одинаковых по существу формулировок второго начала. Удобно процессы, протекающие в термодинамических системах, описывать с помощью энтропии. Понятие энтропии S было впервые введено в 1865 году Рудольфом Клаузиусом при рассмотрении работы тепловой машины, однако смысл его был раскрыт позже Больцманом.
Принцип существования энтропии: система может быть переведена из состояния 1 (с параметрами Р1, V1, T1) в состояние 2 (с параметрами Р2, V2, T2) множеством способов, но при этом одинаковым остается изменение энтропии
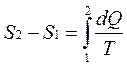
где dQ – количество тепла, полученное системой, а Т – температура системы.
Разность энтропий в двух равновесных состояниях 2 и 1 системы равна приведенному количеству тепла, которое нужно сообщить системе, чтобы перевести ее из состояния 1 в состояние 2.
. В случае обратимого процесса
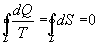
Интеграл по замкнутому контуру - это изменение энтропии во всем цикле, т.е. при обратимых циклах энтропия не меняется: 
Физический смысл имеет не сама энтропия, а ее изменение. Условно энтропию системы при абсолютном нуле принимают равной нулю. Приближенно изменение энтропии можно представить в виде
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 451; Нарушение авторских прав?; Мы поможем в написании вашей работы!