
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: Жидкое и твердое состояния вещества. 3 страница
|
|
|
|
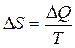
Рассмотрим изолированную систему, состоящую из двух тел с одинаковой теплоемкостью, но с разными температурами (Т2 >Т1).

В системе возникает необратимый процесс теплопроводности. Теплота переходит от нагретого тела 2 к более холодному телу 1. В конце этого процесса температуры станут равными, переход тепла прекратится, система перейдет в состояние термодинамического равновесия. Изменение энтропии первого тела равно 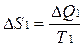 , где Т1 –температура первого тела, ΔQ1 – количество теплоты, полученное первым телом. Изменение энтропии второго тела равно
, где Т1 –температура первого тела, ΔQ1 – количество теплоты, полученное первым телом. Изменение энтропии второго тела равно 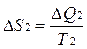 , где Т2 –температура второго тела, ΔQ2 – количество теплоты, отданное вторым телом. Так как система изолированная и других тел нет, то ΔQ1 = - ΔQ2.
, где Т2 –температура второго тела, ΔQ2 – количество теплоты, отданное вторым телом. Так как система изолированная и других тел нет, то ΔQ1 = - ΔQ2.
Общее изменение энтропии системы ΔS = ΔS1 + ΔS2 =  -
-  .
.
Так как Т2 >Т1, то ΔS > 0. Тот же результат получим, если рассмотрим процесс диффузии или необратимые химические реакции.
Второй закон термодинамики: в изолированной системе самопроизвольно могут протекать только те процессы, при которых
происходит увеличение энтропии
Таким образом, энтропия изолированной системы может только возрастать (если в системе протекают необратимые процессы), либо остается постоянной (если в системе протекает обратимый процесс). Убывать энтропия изолированной системы не может. В этом состоит сущность второго закона термодинамики.
В изолированной системе не могут идти процессы, уменьшающие энтропию: теплота не может переходить от холодного тела к более нагретому без дополнительных затрат энергии; газы смешиваются, но не могут сами разделиться и т.д.
4. Смысл понятия энтропии раскрыл Людвиг Больцман с помощью мысленного опыта с молекулами газа.
Пусть в сосуде находятся шесть молекул, которые двигаются хаотически и могут по-разному распределяться в двух половинах сосуда. Распределение 6:0, когда все молекулы собираются в одной половине сосуда реализуется одним способом. Распределение 1:5 реализуется 6 способами (каждая молекула побывает в одной половине сосуда, когда все остальные находятся в другой половине. Распределение 2:4 реализуется 15 способами, распределение 3:3 реализуется 20 способами. Значит, набольшим числом способов реализуется равномерное распределение молекул по объему сосуда, т.е. это состояние наиболее вероятно.
Если в качестве примера взять 12 молекул, то результат еще более убедительный, это видно из приведенной ниже таблицы (верхняя строка – соотношение числа молекул, нижняя – число способов такого распределения)
| 12:0 | 11:1 | 10:2 | 9:3 | 8:4 | 7:5 | 6:6 | 5:7 | 4:8 | 3:9 | 2:10 | 1:11 | 0:12 |
Из этого опыта видно, что наиболее вероятным является такое состояние, в котором равномерно по объему распределены молекулы и их энергии, т.е. состояние термодинамического равновесия. В это состояние в конце концов переходят все изолированные системы и в этом состоянии энтропия максимальна. Больцман установил, что энтропия системы S связана с вероятностью (статистическим весом) состояния системы W соотношением
S = k·ln(W),
где постоянная Больцмана k =1,38·10-23 Дж/К.
Статистический вес состояния системы W экспоненциально растет с ростом S. Иными словами, менее упорядоченное состояние (больший хаос) имеет больший статистический вес, т. к. оно может быть реализовано большим числом способов. Следовательно, энтропия - мера неупорядоченности (беспорядка) системы. Наиболее вероятным состоянием, соответствующим максимуму энтропии, будет равномерное распределение молекул, при этом реализуется и максимальный «беспорядок»
Современная формулировка второго закона термодинамики: все самопроизвольные процессы в природе идут так, что системы переходят из менее вероятного состояния в более вероятное.
5. Круговым процессом (или циклом) называется такой процесс при котором система после ряда изменении возвращается в исходное состояние.
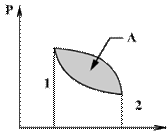
На графике цикл изображается замкнутой кривой. Работа расширения газа из 1 в 2 положительная и равна площади под верхней кривой. Работа сжатия из 2 в 1 отрицательная и равна площади под нижней кривой, поэтому работа, совершаемая при круговом процессе, численно равна разности площадей, то есть равна площади охватываемой замкнутой кривой.
После совершения цикла система возвращается в прежнее состояние. Поэтому всякая функция состояния системы, в частности ее внутренняя энергия, имеет в начале и в конце цикла одинаковое значение.
Тепловые машины построены на принципе круговых процессов.
Тепловая машина состоит из нагревателя, рабочего тела (вещества) и охладителя. В качестве рабочего тела используется пар или газ. Получая теплоту Q1 от нагревателя, газ расширяется и совершает работу, т.е. Q1 = U2 – U1 + A12. Отдавая тепло холодильнику, газ сжимается и - Q2 = U1 – U2 + A21. Складывая эти два выражения, получим Q1- Q2 = A12+ A21 = А (полная работа).
Коэффициент полезного действия тепловой машины

Для получения максимального КПД надо проводить все процессы по возможности обратимо, так как при необратимых процессах теряется тепло бесполезно.
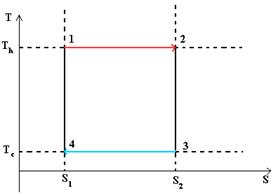
Анализируя работу тепловых двигателей, французский инженер С. Карно в 1824г. пришел к выводу, что наивыгоднейшим круговым процессом является обратимый круговой процесс, состоящий из двух изотермических и двух адиабатических процессов, т.к. он характеризуется наибольшим коэффициентом полезного действия. Такой цикл получил название цикла Карно. В прямом цикле Карно рабочее тело изотермически, а затем адиабатически расширяется, после чего снова изотермически (при более низкой температуре) и потом адиабатически сжимается. Т.е. цикл Карно ограничен двумя изотермами и двумя адиабатами.
При изотермическом расширении от нагревателя отбирается тепло 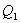 (на участке 1-2 рисунка ниже) Вследствие этого температура газа поддерживается неизменной. Соответственно, параметры точки 2 будут равны
(на участке 1-2 рисунка ниже) Вследствие этого температура газа поддерживается неизменной. Соответственно, параметры точки 2 будут равны  . На участке 2-3 происходит адиабатное расширение. Внутренняя энергия газа уменьшается и его температура падает до Т2. Параметры точки 3 -
. На участке 2-3 происходит адиабатное расширение. Внутренняя энергия газа уменьшается и его температура падает до Т2. Параметры точки 3 - 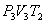 . На участке 3-4 газ изотермически сжимается. Параметры точки 4 -
. На участке 3-4 газ изотермически сжимается. Параметры точки 4 - 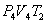 . Выделяющееся при этом тепло
. Выделяющееся при этом тепло 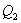 отбирается холодильником. Участок 4-1 -адиабатическое сжатие до исходного состояния, соответствующего точке 1. Таким образом, завершен цикл “1-2-3-4-1 и в итоге нагреватель отдал газу теплоту
отбирается холодильником. Участок 4-1 -адиабатическое сжатие до исходного состояния, соответствующего точке 1. Таким образом, завершен цикл “1-2-3-4-1 и в итоге нагреватель отдал газу теплоту 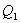 , а холодильник отобрал
, а холодильник отобрал 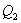 Разность
Разность 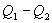 определяет полезную работу газа за один цикл, так как согласно I началу термодинамики
определяет полезную работу газа за один цикл, так как согласно I началу термодинамики 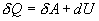 , но для кругового процесса
, но для кругового процесса  и, следовательно
и, следовательно 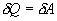 .
.

Отношение полезной работы к затраченной энергии нагревателя определяет коэффициент полезного действия (к.п.д.) тепловой машины:
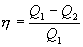
Эта формула справедлива для любого обратимого и необратимого процесса.
Можно показать, что для обратимого процесса
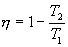 .
.
Тепловые машины тем выгоднее, чем выше температура нагревателя и ниже температура холодильника.
Процессы, изменяющие содержание теплоты в системе, ведут к изменению энтропии (см.рисунок), но в результате совершения полного кругового процесса энтропия системы не изменяется.
Выбор рабочего вещества диктуется соображениями технической и экономической целесообразности. В паросиловых установках тепловых электростанций используется пар, он доступен и прост в обращении. В двигателях внутреннего сгорания используется смесь воздуха с горючим. При горении создается температура выше и КПД выше.
Лекция 9
Вопросы: 1) Свойства жидкостей
2) Кристаллы и аморфные вещества
1. Все газы можно перевести в жидкое состояние, если достаточно сильно сжать их или охладить. Примером служит вода, образующаяся при конденсации пара (рис.)

1 –пар 2 - вода
Для каждого газа есть так называемая критическая температура Tc, ниже которой он всегда может быть ожижен путем повышения давления; выше Tc газ не может быть ожижен ни при каких условиях.
Молекулы вещества в жидком состоянии расположены почти вплотную друг к другу. В отличие от твердых кристаллических тел, в которых молекулы образуют упорядоченные структуры во всем объеме кристалла и могут совершать тепловые колебания около фиксированных центров, молекулы жидкости обладают большей свободой. Каждая молекула жидкости, также как и в твердом теле, «зажата» со всех сторон соседними молекулами и совершает тепловые колебания около некоторого положения равновесия. Однако, время от времени любая молекула может переместиться в соседнее вакантное место. Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей. Из-за сильного взаимодействия между близко расположенными молекулами они могут образовывать локальные (неустойчивые) упорядоченные группы, содержащие несколько молекул. Это явление называется ближним порядком (рис.).
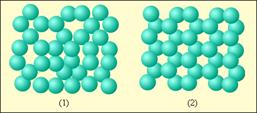
1- вода (ближний порядок)
2 – лед (дальний порядок)
Вследствие плотной упаковки молекул сжимаемость жидкостей, то есть изменение объема при изменении давления, очень мала; она в десятки и сотни тысяч раз меньше, чем в газах.
Тепловое расширение воды имеет интересную и важную для жизни на Земле аномалию. При температуре ниже 4 °С вода расширяется при понижении температуры. Максимум плотности ρв = 103 кг/м3 вода имеет при температуре 4 °С. При замерзании вода расширяется, поэтому лед остается плавать на поверхности замерзающего водоема. Температура замерзающей воды подо льдом равна 0 °С. В более плотных слоях воды у дна водоема температура оказывается порядка 4 °С. Благодаря этому может существовать жизнь в воде замерзающих водоемов.
Жидкость, в отличие от газов, не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела, которая находится в особых условиях по сравнению с остальной массой жидкости. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон.
Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости (силами, действующими на данную молекулу жидкости со стороны молекул газа (или пара) можно пренебречь).
В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы попасть некоторому количеству молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), им надо обладать большой кинетической энергией, чтобы совершить работу против сил притяжения. В результате они приобретают запас потенциальной энергии.
Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия ΔU поверхности жидкости пропорциональна ее площади ΔS:
ΔU = σΔS
Коэффициент σ называется коэффициентом поверхностного натяжения и равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
Свободная поверхность жидкости стремится сократить свою площадь, т.к. равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения. Например, они придают свободной капле жидкости шарообразную форму.
Если в мыльный раствор опустить проволочную рамку, одна из сторон которой подвижна, то вся она затянется пленкой жидкости. Силы поверхностного натяжения стремятся сократить поверхность пленки и подвижная сторона рамки переместится. Подобрав внешнюю уравновешивающую силу можно определить силу поверхностного натяжения.
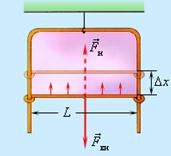
Вблизи границы между жидкостью, твердым телом и газом форма свободной поверхности жидкости зависит от сил взаимодействия молекул жидкости с молекулами твердого тела (взаимодействием с молекулами газа (или пара) можно пренебречь). Если эти силы больше сил взаимодействия между молекулами самой жидкости, то жидкость смачивает поверхность твердого тела. В этом случае жидкость подходит к поверхности твердого тела под некоторым острым углом θ, характерным для данной пары жидкость – твердое тело (см.рисунок).

1 – смачивающая жидкость
2 – несмачивающая жидкость
Угол θ называется краевым углом. Если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела, то краевой угол θ оказывается тупым (рис. 3.5.5). В этом случае говорят, что жидкость не смачивает поверхность твердого тела. При полном смачивании θ = 0, при полном несмачивании θ = 180°.
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. На рис. изображена капиллярная трубка некоторого радиуса r, опущенная нижним концом в смачивающую жидкость плотности ρ.
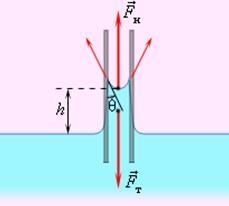
Верхний конец капилляра открыт. Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести, действующая на столб жидкости высотой h в капилляре, не станет равной по модулю результирующей Fн сил поверхностного натяжения, действующих вдоль границы соприкосновения жидкости с поверхностью капилляра: Fт = Fн, где Fт = mg = ρhπr2g, Fн = σ2πr cos θ. Отсюда следует:
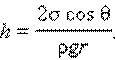
При полном смачивании θ = 0, cos θ = 1. В этом случае
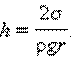
При полном несмачивании θ = 180°, cos θ = –1 и, следовательно, h < 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр. Вода практически полностью смачивает чистую поверхность стекла. Наоборот, ртуть полностью не смачивает стеклянную поверхность. Поэтому уровень ртути в стеклянном капилляре опускается ниже уровня в сосуде.
2. По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества.
Типы кристаллов
а) ионные;
б) атомные;
в) металлические;
г) молекулярные.
В ионных кристаллах кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы NaCl. Каждый катион притягивается к каждому аниону и отталкивается от других катионов. Весь кристалл можно считать огромной молекулой. Размеры такой молекулы не ограничены, поскольку она может расти, присоединяя новые катионы и анионы.
Большинство ионных соединений кристаллизуется по одному из структурных типов, которые отличаются друг от друга значением координационного числа, то есть числом соседей вокруг данного иона (4, 6 или 8). Для ионных соединений с равным числом катионов и анионов известно четыре основных типа кристаллических решеток: хлорида натрия (координационное число обоих ионов равно 6), хлорида цезия (координационное число обоих ионов равно 8), сфалерита и вюрцита (оба структурных типа характеризуются координационном числом катиона и аниона, равным 4). Если число катионов вдвое меньше числа анионов, то координационное число катионов должно быть вдвое больше координационного числа анионов. В этом случае реализуются структурные типы флюорита (координационные числа 8 и 4), рутила (координационные числа 6 и 3), кристобалита (координационные числа 4 и 2).
Обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Высокая растворимость в полярных растворителях, сопровождающаяся электролитической диссоциацией обусловлена тем, что в среде растворителя с высокой диэлектрической проницаемостью ε уменьшается энергия притяжения между ионами. Диэлектрическая проницаемость воды в 82 раза выше, чем вакуума (условно существующего в ионном кристалле), во столько же раз уменьшается притяжение между ионами в водном растворе. Эффект усиливается за счет сольватации ионов.
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы.
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. Они очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Межмолекулярные силы возникают за счет электростатического взаимодействия отрицательно заряженных электронов одной молекулы с положительно заряженными ядрами соседних молекул. На силу межмолекулярного взаимодействия влияет много факторов. Важнейшими среди них является наличие полярных связей, то есть смещения электронной плотности от одних атомов к другим. Кроме того, межмолекулярное взаимодействие проявляется сильнее между молекулами с большим числом электронов.
Большинство неметаллов в виде простых веществ (например, иод I2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами.
Положительно заряженные ионы металла, образующие кристаллическую решетку, удерживаются вблизи положений равновесия силами взаимодействия с «газом свободных электронов» (рис.). Электронный газ образуется за счет одного или нескольких электронов, отданных каждым атомом. Свободные электроны способны блуждать по всему объему кристалла.

|
В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.
Для наглядного представления внутренней структуры кристалла применяется способ изображения его с помощью пространственной кристаллической решетки. Кристаллической решеткой называется пространственная сетка, узлы которой совпадают с центрами атомов или молекул в кристалле. В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно.
Кристаллы могут иметь форму различных призм и пирамид, в основании которых могут лежать только правильный треугольник, квадрат, параллелограмм и шестиугольник.
Представления о периодической структуре кристаллов и симметрии расположения атомов в них в настоящее время имеют строгое экспериментальное подтверждение.
Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо) (см. рис.).

Простые кристаллические решетки: 1 – простая кубическая решетка; 2 –гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка
В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. 3.6.1 решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–. В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
Классификация кристаллических решеток отвечает предельным случаям. Большинство кристаллов неорганических веществ принадлежит к промежуточным типам - ковалентно-ионным, молекулярно-ковалентным и т.д. Например, в кристалле графита внутри каждого слоя связи ковалентно-металлические, а между слоями - межмолекулярные.
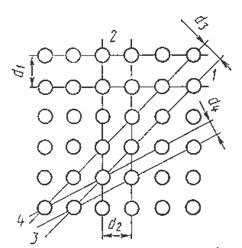
Физические свойства кристаллических тел неодинаковы в различных направлениях, но совпадают в параллельных направлениях. Это свойство кристаллов называется анизотропностью. Кристалл поваренной соли при раскалывании дробится на части, ограниченные плоскими поверхностями, пересекающимися под прямыми углами. Эти плоскости перпендикулярны особым направлениям в образце, по этим направлениям его прочность минимальна.
Анизотропия механических, тепловых, электрических и оптических свойств кристаллов объясняется тем, что при упорядоченном расположении атомов, молекул или ионов силы взаимодействия между ними и межатомные расстояния оказываются неодинаковыми по различным направлениям (рис. 98).
Основными свойствами кристаллических тел являются: определенность температуры плавления рис.), упругость, прочность, зависимость свойств от порядка расположения атомов, т. е. от типа кристаллической решетки.

Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом. Поликристаллическую структуру чугуна, например, можно обнаружить, если рассмотреть с помощью лупы образец на изломе. Каждый маленький монокристалл поликристаллического тела анизотропен, но поликристаллическое тело изотропно.
Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом. Переход из одной модификации в другую называется полиморфным переходом. Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60–100 тысяч атмосфер и температурах 1500–2000 К. В случае молекулярных кристаллов полиморфизм проявляется в различной упаковке молекул в кристалле или в изменении формы молекул, а в ионных кристаллах - в различном взаимном расположении катионов и анионов. Некоторые простые и сложные вещества имеют более двух полиморфных модификаций. Например, диоксид кремния имеет десять модификаций, фторид кальция - шесть, нитрат аммония - четыре. Полиморфные модификации принято обозначать греческими буквами α, β, γ, δ, ε,... начиная с модификаций, устойчивых при низких температурах.
Изоморфизм заключается в способности атомов, ионов или молекул замещать друг друга в кристаллических структурах. При совместной кристаллизации веществ, склонных к изоморфизму (изоморфных веществ), образуются смешанные кристаллы (изоморфные смеси). Это возможно лишь в том случае, если замещающие друг друга частицы мало различаются по размерам (не более 15%). Кроме того, изоморфные вещества должны иметь сходное пространственное расположение атомов или ионов и, значит, сходные по внешней форме кристаллы. К таким веществам относятся, например, квасцы. В кристаллах алюмокалиевых квасцов KAl(SO4)2 . 12H2O катионы калия могут быть частично или полностью заменены катионами рубидия или аммония, а катионы алюминия - катионами хрома(III) или железа(III).
Изоморфизм широко распространен в природе. Большинство минералов представляет собой изоморфные смеси сложного переменного состава. Например, в минерале сфалерите ZnS до 20% атомов цинка могут быть замещены атомами железа (при этом ZnS и FeS имеют разные кристаллические структуры). С изоморфизмом связано геохимическое поведение редких и рассеянных элементов, их распространение в горных породах и рудах, где они содержатся в виде изоморфных примесей.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 660; Нарушение авторских прав?; Мы поможем в написании вашей работы!