
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутрикомплексные соединения. Полиядерные комплексы. Комплексные соединения в биологических системах. Понятие о строении гемоглобина
|
|
|
|
Константы нестойкости комплексных ионов
Поведение кс в растворах
Природа химических связей в КС. Геометрия комплексного иона.
Согласно методу валентных связей *, образование комплексных соединений * осуществляется за счет донорно-акцепторного * взаимодействия между комплексообразователем * и лигандами *. Обычно центральный атом имеет свободные орбитали *, а лиганды имеют неподеленные электронные пары. В образовании такой координационной связи могут участвовать ns-, np-, nd- или (n–1)d- орбитали, где n – номер внешнего электронного слоя комплексообразователя. Координационное число * определяется гибридизацией * орбиталей центрального атома:
| КЧ | |||
| Гибридизация | sp | sp3, dsp2 | sp3d2, d2sp3 |
Геометрия комплексного иона определяется типом гибридизации свободных орбиталей ЦА
Диссоциация ионов, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой равновесия, называемой константой нестойкости комплексного иона.
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Константы нестойкости, в выражения которых входят концентрации ионов и молекул, называются «концентрационными». Более строгими и не зависящими от концентраций и ионной силы раствора являются константы нестойкости, содержащие вместо концентраций активности ионов и молекул.
В последнее время для характеристики устойчивости комплексных соединений предпочитают пользоваться величиной, обратной константе нестойкости, называемой константой устойчивости.
До сих пор шла речь об общих константах нестойкости и, устойчивости, относящихся к распаду комплекса на конечные продукты. В действительности же в растворах имеет место ступенчатая диссоциация комплекса, аналогично ступенчатой диссоциации слабых электролитов, например многоосновных кислот.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости.
Внутрикомплексные соединения (хелаты) — образуются, при взаимодействии ионов металлов с молекулами некоторых органических веществ. В молекулах Внутрикомплексных соединений имеется шестичленный или пятичленный цикл. Напр., внутрикомплексное соединение Be (П) с ацетил ацетоном (в енольной форме) СН3—СO—СН=С(OH)—СН3 имеет следующее строение:
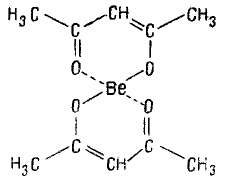
Ацетилацетон присоединен к центральному атому (иону-комплексообразователю) бериллию как за счет главной валентности (сплошная черта), так и за счет побочной валентности (обозначена пунктиром). Внутрикомплексные соединения используют в химии для разделения, концентрирования и определения различных элементов.
ПОЛИЯДЕРНЫЕ СОЕДИНЕНИЯ (многоядерные соед.), координац. соед., в молекулах к-рьгх имеется неск. атомовметаллов, окруженных лигандами и связанных друг с другом посредством мостиковых групп. Наиб. изучены би-и триядерные координац. соединения. Когда число атомов металлов велико, такие соед. наз. координационными или металлсодержащими полимерами, металлополимерами (см. Координационные полимеры). Соотношение между полиядерными соединениями и координац. полимерами такое же, как и между мономерами (и олигомерами) иполимерами в карбоцепных высокомол. соединениях. К полиядерным соединениям иногда относят соед., содержащие ячейки из непосредственно связанных друг с другом атомов металлов, обычно наз. кластерами. Различают гомо- и ге-терометаллические полиядерные соединения. Расстояния металл-металл в полиядерных соединениях варьируют в широких пределах, иногда могут достигать 1 нм и более.
Комплексные соединения – основная форма присутствия ионов металлов в биологических системах. Функции ионов металлов в живых системах: каталитическая, транспортная, перенос электронов, передача нервных импульсов, регуляторная.
Основные аспекты бионеорганической химии некоторых металлов в биологических системах:
• роль железа и меди в энергетике клетки: металлопорфирины гем – белки, медьсодержащие оксидазы;
• магний и фотосинтез: металлопорфирин хлорофилл;
• фиксация атмосферного азота при помощи нитрогеназы – комплекса белков, содержащих железо и молибден;
• многофункциональные ионы (Co2+, Ca2+, K+, Na+): кобаламин, его производное витамин В12; роль кальция в функционировании костно-мышечной системы и свертывании крови; роль ионов K+ и Na+ в распространении нервных импульсов.
Гемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложныйжелезосодержащий белоккровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится вэритроцитах, у большинствабеспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1].
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1793; Нарушение авторских прав?; Мы поможем в написании вашей работы!