
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные различия в строении белковых молекул
|
|
|
|
СТРОЕНИЕ И СВОЙСТВА БЕЛКОВ.
БЕЛКИ или ПРОТЕИНЫ - это высокомолекулярные азотсодержащие органические вещества, линейные гетерополимеры, структурным компонентом которых являются аминокислоты, связанные пептидными связями.
Кроме понятия «белок», в химии встречается термины «ПЕПТИД» и «ПОЛИПЕПТИД». Пептидом обычно называют олигомер, состоящий не более чем из 10 аминокислот. Но встречаются и молекулы, содержащие от 10 до 100 аминокислот – они относятся к группе небольших ПОЛИПЕПТИДОВ, крупные же полипептиды могут содержать и более 100 аминокислот. Столько же аминокислот могут содержать и некоторые небольшие белки. Поэтому граница по количеству аминокислотных остатков, а, стало быть, и по молекулярной массе, между белками и полипептидами, весьма условна.
В природе встречаются десятки тысяч различных белков. И все они отличаются друг от друга по пяти основным признаком.
1. По количеству аминокислот
2. По соотношению количества различных аминокислот. Например, в белке соединительной ткани коллагене 33% от общего количества аминокислот составляет глицин, а в молекуле белкового гормона инсулина, вырабатываемого в поджелудочной железе, содержание глицина гораздо меньше – всего 8%.
3. Различная последовательность чередования аминокислот. Это означает, что даже при одинаковом соотношении разных аминокислот в каких-нибудь двух белках порядок их расположения этих аминокислот различен, то это будут разные белки.
4. Количество полипептидных цепей в различных белках может варьировать от 1 до 12, но если больше единицы, то обычно четное (2, 4, 6 и т.п.)
5. По наличию небелкового компонента, который называется «ПРОСТЕТИЧЕСКАЯ ГРУППА». Если ее нет, то это – простой белок, если есть – сложный белок
В природе встречается около 150 аминокислот. Для построения белков используются только 20 из них, хотя в метаболизме организма человека участвует большее количество аминокислот. Эти 20 аминокислот имеют несколько общих признаков строения (общие свойства аминокислот):
1. Все они являются альфа-аминокислотами. Аминогруппа общей части всех аминокислот присоединена к альфа-углеродному атому.

|
2. По стереохимической конфигурации альфауглеродного атома все они принадлежат к L-ряду.
Следовательно, все эти 20 аминокислот имеют совершенно одинаковый фрагмент молекулы. Различаются они по строению радикалов.
Молекула воды обладает полярными свойствами.
Атом кислорода сильнее притягивает электроны, чем атомы водорода, поэтому электронное облако смещено в сторону кислорода. Степень полярности определяется величиной частичных зарядов и расстоянием между центрами тяжести этих зарядов. Таким образом, молекула воды является диполем.
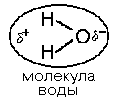
|

|
Молекулы воды структурированы и образуют кластеры.
В эти кластерные структуры хорошо встраиваются молекулы, которые сами являются полярными, потому что полярные вещества хорошо растворимы в воде. Полярными являются все те молекулы, которые содержат электроотрицательные атомы. В молекулах белков электроотрицательными атомами являются O (кислород), N (азот) и S (сера).
Высокая полярность обеспечивает остальные общие свойства аминокислот:
3. Хорошая растворимость в воде благодаря наличию общего фрагмента молекулы. Общий фрагмент обладает полярными свойствами, потому что содержит карбоксильную группу –COOH (при физиологическом значении pH эта группа заряжена отрицательно), и аминогруппы -NH2 (при физиологическом значении pH заряжена положительно).
4. Способность к электролитической диссоциации. Аминокислоты существуют в водном растворе в виде амфионов (биполярных ионов). В целом такая молекула при нейтральном значении pH (при pH=7) электронейтральна.

|
5. Наличие ИЗОЭЛЕКТРИЧЕСКОЙ ТОЧКИ (ИЭТ, pI). (ИЭТ) - это значение pH среды, при котором молекула амфотерного вещества (например, аминокислоты) находится в электронейтральном состоянии.
РАЗЛИЧИЯ В СТРОЕНИИ АМИНОКИСЛОТ
Радикалы аминокислот могут значительно отличаться друг от друга по строению.
Если есть дополнительные карбоксильные группы в радикале, то заряд молекулы в нейтральной среде отрицателен, а ИЭТ такой молекулы находится в кислой среде.
Аминокислота, в радикале которой есть дополнительная аминогруппа (NH2-группа), в нейтральной среде заряжена положительно. ИЭТ такой аминокислоты находится в щелочной среде (pI>7). К таким аминокислотам относятся лизин, аргинин и гистидин.
Аминокислота, в радикале которой есть дополнительная карбоксильная группа (COOH-группа), в нейтральной среде заряжена отрицательно. ИЭТ такой аминокислоты находится в кислой среде (pI<7). К ним относятся аспарагиновая кислота и глутаминовая кислота.
С помощью значения рН внешней среды характеризуют соотношение -СООН и -NH2 групп. Это относится и к пептидам, и к белкам.
Различные функциональные группы, содержащиеся в радикалах аминокислот, придают им способность к взаимодействию с образованием разных типов соединений. Приведем примеры таких взаимодействий.


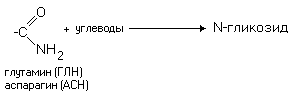


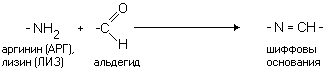
В связи с различиями в строении радикалов различны и физико-химические свойства аминокислот.
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ.
Существуют три типа классификации:
I. ФИЗИКО-ХИМИЧЕСКАЯ – основана на различиях в физико-химических свойствах аминокислот.
1) Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы, где равномерно распределена электронная плотность и нет никаких зарядов и полюсов. В их составе могут присутствовать и электроотрицательные элементы, но все они находятся в углеводородном окружении. Например, в радикале метионина сера окружена углеводородными группировками, которые не позволяют этому элементу проявлять своих электроотрицательных свойств: -(CH2)2-S-CH3. Аналогичная ситуация наблюдается, например, и в отношении азота, находящегося в составе радикала триптофана.
2) Гидрофильные незаряженные (полярные) аминокислоты. Радикалы таких аминокислот содержат в своем составе полярные группировки:

Эти группы взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них.
3) Отрицательно заряженные аминокислоты. Сюда относятся аспарагиновая и глутаминовая кислоты. Имеют дополнительную СООН-группу в радикале - в нейтральной среде приобретают отрицательный заряд.

Все они гидрофильны.
4) Положительно заряженные аминокислоты: аргинин, лизин и гистидин. Имеют дополнительную NH2-группу (или имидазольное кольцо, как гистидин) в радикале - в нейтральной среде приобретают положительный заряд.
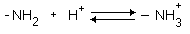
Все они также являются гидрофильными.
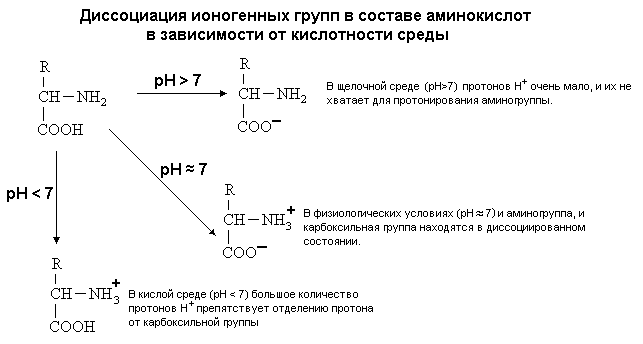
Такие свойства характерны для свободных аминокислот. В белке же ионогенные группы общей части аминокислот участвуют в образовании пептидной связи, и все свойства белка определяются только свойствами радикалов аминокислот.
Не все аминокислоты, принимающие участие в построении белков человеческого тела, способны синтезироваться в нашем организме. На этом основана еще одна классификация аминокислот - биологическая.
II. Биологическая классификация.
а) Незаменимые аминокислоты, их еще называют "эссенциальные". Они не могут синтезироваться в организме человека и должны обязательно поступать с пищей. Их 8 и еще 2 аминокислоты относятся к частично незаменимым.
Незаменимые: метионин, треонин, лизин, лейцин, изолейцин, валин, триптофан, фенилаланин.
Частично незаменимые: аргинин, гистидин.
а) Заменимые (могут синтезироваться в организме человека). Их 10: глутаминовая кислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин.
III. Химическая классификация - в соответствии с химической структурой радикала аминокислоты (алифатические, ароматические).
Белки синтезируются на рибосомах, не из свободных аминокислот, а из их соединений с транспортными РНК (т-РНК).
Этот комплекс называется «аминоацил-т-РНК».
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 397; Нарушение авторских прав?; Мы поможем в написании вашей работы!