
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы связей между аминокислотами в молекуле белка
|
|
|
|
2 группы:
1. КОВАЛЕНТНЫЕ СВЯЗИ - обычные прочные химические связи.
а) пептидная связь
б) дисульфидная связь
2. НЕКОВАЛЕНТНЫЕ (СЛАБЫЕ) ТИПЫ СВЯЗЕЙ - физико-химические взаимодействия родственных структур. В десятки раз слабее обычной химической связи. Очень чувствительны к физико-химическим условиям среды. Они неспецифичны, то есть соединяются друг с другом не строго определенные химические группировки, а самые разнообразные химические группы, но отвечающие определенным требованиям.
а) Водородная связь
б) Ионная связь
в) Гидрофобное взаимодействие
ПЕПТИДНАЯ СВЯЗЬ.
Формируется за счет COOH-группы одной аминокислоты и NH2-группы соседней аминокислоты. В названии пептида окончания названий всех аминокислот, кроме последней, находящейся на «С»-конце молекулы меняются на «ил»
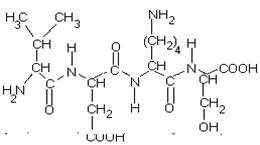
Тетрапептид: валил-аспарагил-лизил-серин
|
ПЕПТИДНАЯ СВЯЗЬ формируется ТОЛЬКО ЗА СЧЕТ АЛЬФА-АМИНОГРУППЫ И СОСЕДНЕЙ COOH-ГРУППЫ ОБЩЕГО ДЛЯ ВСЕХ АМИНОКИСЛОТ ФРАГМЕНТА МОЛЕКУЛЫ!!! Если карбоксильные и аминогруппы входят в состав радикала, то они никогда(!) не участвуют в формировании пептидной связи в молекуле белка.
Любой белок - это длинная неразветвленная полипептидная цепь, содержащая десятки, сотни, а иногда более тысячи аминокислотных остатков. Но какой бы длины ни была полипептидная цепь, всегда в основе ее - стержень молекулы, абсолютно одинаковый у всех белков. Каждая полипептидная цепь имеет N-конец, на котором находится свободная концевая аминогруппа и С-конец, образованный концевой свободной карбоксильной группой. На этом стержне сидят как боковые веточки радикалы аминокислот. Числом, соотношением и чередованием этих радикалов один белок отличается от другого. Сама пептидная связь является частично двойной в силу лактим-лактамной таутомерии. Поэтому вокруг нее невозможно вращение, а сама она по прочности в полтора раза превосходит обычную ковалентную связь. На рисунке видно, что из каждых трех ковалентных связей в стержне молекулы пептида или белка две являются простыми и допускают вращение, поэтому стержень (вся полипептидная цепь) может изгибаться в пространстве.
Хотя пептидная связь довольно прочная, ее сравнительно легко можно разрушить химическим путем – кипячением белка в крепком растворе кислоты или щелочи в течении 1-3 суток.
К ковалентным связям в молекуле белка помимо пептидной, относится также ДИСУЛЬФИДНАЯ СВЯЗЬ.
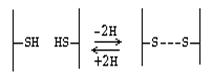
Цистеин - аминокислота, которая в радикале имеет SH-группу, за счет которой и образуются дисульфидные связи.
|
Дисульфидная связь - это ковалентная связь. Однако биологически она гораздо менее устойчива, чем пептидная связь. Это объясняется тем, что в организме интенсивно протекают окислительно-восстановительные процессы. Дисульфидная связь может возникать между разными участками одной и той же полипептидной цепи, тогда она удерживает эту цепь в изогнутом состоянии. Если дисульфидная связь возникает между двумя полипептидами, то она объединяет их в одну молекулу.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 442; Нарушение авторских прав?; Мы поможем в написании вашей работы!