
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Учения о растворах. Буферные системы
|
|
|
|
1. Задание {{ 376 }} ТЗ № 376
Ацетатная буферная система состоит из
- H2CO3 и NaHCO3
+CH3COOH и CH3COONa
- Na2HPO4 и NaH2PO4
- NH4OH и NH4Cl
2. Задание {{ 377 }} ТЗ № 377
Бикарбонатная буферная система состоит из
+ H2CO3 и KHCO3
- CH3COOH и CH3COONa
- NaH2PO4 и Na2HPO4
- NH4OH и NH4Cl
3. Задание {{ 378 }} ТЗ № 378
Фосфатная буферная система состоит из
- H2CO3 и KHCO3
- CH3COOH и CH3COONa
+ NaH2PO4 и Na2HPO4
- NH4OH и NH4Cl
4. Задание {{ 379 }} ТЗ № 379
Аммиачная буферная система состоит из
- H2CO3 и KHCO3
- CH3COOH и CH3COONa
- NaH2PO4 и Na2HPO4
+ NH4OH и NH4Cl
5. Задание {{ 380 }} ТЗ № 380
pH буферного раствора состоящего из слабой кислоты и ее соли образованной сильным основанием можно рассчитать по формулам
+ pH = pK + lg 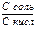
- pH = 14-pK - lg 
+pH = pK - lg 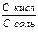
- pH = pK - lg 
6. Задание {{ 381 }} ТЗ № 381
pH буферного раствора состоящего из слабого основания и ее соли образованной сильной кислотой можно рассчитать по формуле
- pH = pK + lg 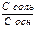
- pH = pK - lg 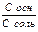
+ pH = 14-pK - lg 
- pH = 14-pK + lg 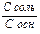
7. Задание {{ 382 }} ТЗ № 382
Соотношение между концентрациями соли и слабой кислоты в буферной системе с pH=1,35 и pKk=2,35
- 1:1
- 1:2
- 1:5
+ 1:10
8. Задание {{ 383 }} ТЗ № 383
pH буферного раствора, содержащего 3,6 мл 0,2 н NH4Cl и 3,6 мл 0,2 н NH4OH, если KNH 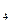 OH=10-5
OH=10-5
- 2
- 4
- 5
+ 9
9. Задание {{ 384 }} ТЗ № 384
pH ацетатной буферной системы равен 5. Константа диссоциации уксусной кислоты в такой системе, если соотношение между компонентами близко к 1 равна
- 10-3
+ 10-5
- 10-9
- 10-14
10. Задание {{ 385 }} ТЗ № 385
Отметьте правильный ответ. pH ацетатной буферной смеси, состоящей из 100 мл 0,2 н CH3COOH и 200 мл 0,1 н CH3COONa, если KCH 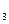 COOH = 10-6
COOH = 10-6
- 4
+ 6
- 8
- 10
11. Задание {{ 386 }} ТЗ № 386
Соотношение между концентрациями слабой кислоты и ее соли в буферной системе имеющей pH=11, а pKk=9
- 1:1
- 1:5
- 1:10
+ 1:100
12. Задание {{ 387 }} ТЗ № 387
pH буферной системы CH3COOH+CH3COONa, содержащей по 0,25 моль/л каждого из веществ, если KCH 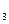 COOH=10-5
COOH=10-5
- 2
- 3
- 4
+ 5
13. Задание {{ 388 }} ТЗ № 388
pH буферного раствора, содержащего 3,6 мл 0,2 н NH4Cl и 2,4 мл 0,3 н NH4OH, если KNH 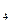 OH=10-5
OH=10-5
- 3
- 5
+ 9
- 14
14. Задание {{ 389 }} ТЗ № 389
pH буферного системы состоящей из СH3COOH и CH3COONa, если соотношение между компонентами равно 1, а KСH  COOH=10-6 равен
COOH=10-6 равен
- 3
- 5
+ 6
- 8
15. Задание {{ 390 }} ТЗ № 390
pH буферного раствора, содержащего 5 мл 0,1 н NH4Cl и 5 мл 0,1 н NH4OH, если KNH 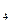 OH=10-6
OH=10-6
- 5
- 6
- 7
+ 8
16. Задание {{ 391 }} ТЗ № 391
Приготовим раствор, содержащий уксусную кислоту и ацетат натрия в равных молярных концентрациях. pH такого раствора, если KСH  COOH=10-5 равен
COOH=10-5 равен
- 2
- 4
+ 5
- 9
17. Задание {{ 392 }} ТЗ № 392
Буферную емкость можно рассчитать по формуле
- 
+ 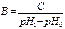
- 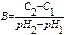
18. Задание {{ 393 }} ТЗ № 393
В состав крови входит буферных систем
- 1
- 2
- 3
+ 4
19. Задание {{ 394 }} ТЗ № 394
Самая мощная буферная система крови
- бикарбонатная
- фосфотная
+ гемоглобиновая
- белковая
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 881; Нарушение авторских прав?; Мы поможем в написании вашей работы!