
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
|
|
|
|
Учения о растворах
Ионное произведение воды и водородный показатель.
Учения о растворах
1. Задание {{ 278 }} ТЗ № 278
Отметьте правильный ответ
pH 0,0001 н. раствора KOH равен
- - ln 10-4
- - lg 10-4
+ 14+lg 10-4
- 14-lg 10-4
2. Задание {{ 279 }} ТЗ № 279
Отметьте правильный ответ
Концентрация гидроксидных ионов в растворе с pH=8 равна (моль/л)
- - lg 10-8
- lg 10-6
- 10-8
- ln 10-8
+ 10-6
3. Задание {{ 280 }} ТЗ № 280
Отметьте правильный ответ
Концентрация ионов водорода в растворе с pH=4 равна (моль/л)
- 10
- 4
+ 10-4
- e-10
- 10-10
4. Задание {{ 281 }} ТЗ № 281
Отметьте правильный ответ
pH 0,01 н. раствора слабого однокислого основания равен 10. Константа диссоциации этого основания равна
- 10-20
- 10-18
- 10-10
- 10-8
+ 10-6
5. Задание {{ 282 }} ТЗ № 282
Отметьте правильный ответ
pH 0,0001 н. раствора HClO4 равен
- 0,0001
- ln 10-4
+ - lg 10-4
- - ln 10-4
+ 4
6. Задание {{ 283 }} ТЗ № 283
Отметьте правильный ответ
pH раствора равен 10. Концентрация гидроксид-ионов в таком растворе равна (моль/л)
- 10
- 4
+ 10-4
- 10-10
- e-10
7. Задание {{ 284 }} ТЗ № 284
Отметьте правильный ответ
В 0,001 н. растворе одноосновной кислоты НА концентрация водородных ионов равна 10-4. Константа диссоциации такой кислоты равна
- 10-8
+ 10-5
- 105
- 10-3
- 103
8. Задание {{ 285 }} ТЗ № 285
Отметьте правильный ответ
pH 0,001 н. раствора NaOH равен
- 10-3
- 103
- 3
- 13
+ 11
9. Задание {{ 286 }} ТЗ № 286
Отметьте правильный ответ
pOH раствора равен 12. Концентрация ионов водорода в таком растворе равна (моль/л)
+ 0,01
- 100
- 2
- 12
- 10
10. Задание {{ 287 }} ТЗ № 287
Отметьте правильный ответ
В 0,01 н. растворе слабой одноосновной кислоты НА концентрация ионов водорода 10-3. Константа диссоциации такой кислоты равна
- 10-2
- 10-3
- 10-5
- 10-6
+ 10-4
11. Задание {{ 288 }} ТЗ № 288
Отметьте правильный ответ
pH 0,01 н. раствора HCl равен
- 0,01
- 0,1
- 1
+ 2
- 10
12. Задание {{ 290 }} ТЗ № 290
Отметьте правильный ответ
В 1 л раствора содержится 3,65 г HCl. pOH такого раствора равен
- 14
+ 13
- 10
- 4
- 0,25
13. Задание {{ 292 }} ТЗ № 292
Отметьте правильный ответ
pOH раствора равен 10. Концентрация ионов водорода в таком растворе равна
- 0,01
- 100
- 2
- 12
+ 10-4
14. Задание {{ 298 }} ТЗ № 298
Отметьте правильный ответ
Концентрация ионов водорода в растворе равна 10-3. pH такого раствора равен
- 1
- 2
+ 3
- 4
- 5
15. Задание {{ 300 }} ТЗ № 300
Отметьте правильный ответ
Ионное произведение воды равно
- 10-4
- 10-10
+ 10-14
- 10-16
16. Задание {{ 301 }} ТЗ № 301
Отметьте правильный ответ
pH раствора равен 3. Концентрация гидроксидных ионов в этом растворе равна
- 11
- 10
- 10-3
+ 10-11
- 10-14
17. Задание {{ 302 }} ТЗ № 302
Отметьте правильный ответ
pOH раствора равен 5. pH такого раствора равен
- 6
+ 9
- 10-5
- 10-11
- 14
18. Задание {{ 303 }} ТЗ № 303
Отметьте правильный ответ
pH раствора 8. pOH такого раствора равен
- 10-8
- 10-6
+ 6
- 8
- 10
1. Задание {{ 304 }} ТЗ № 304
Среда кислая в водных растворах солей
- K2CO3
- KCl
+ CuCl2
+ Fe (NO3)3
- NaNO3
2. Задание {{ 305 }} ТЗ № 305
Кислые соли образуются при гидролизе солей
- NaCl
+ K2CO3
- AlCl3
+ Na3PO4
- KNO2
3. Задание {{ 306 }} ТЗ № 306
Щелочная среда в водных растворах солей
+ Na3PO4
+ K2СO3
+ Na2S
- NaCl
- KNO3
4. Задание {{ 307 }} ТЗ № 307
В водном растворе гидролизу подвергаются соли
- NaNO3
+ MgCl2
+ FeCl3
+ (NH4)2SO4
5. Задание {{ 308 }} ТЗ № 308
Нейтральная или близкая к нейтральной среда в водных растворах солей
+ KNO3
+ CH3COONH4
- Na2CO3
- CuCl2
6. Задание {{ 309 }} ТЗ № 309
Фенолфталеин малиновый в водных растворах солей
- KCl
+ K2CO3
+ KHCO3
- KNO3
- Cu(NO3)2
7. Задание {{ 310 }} ТЗ № 310
Основные соли образуются при гидролизе солей
- NH4NO3
+ CuCl2
- Na2CO3
+ Al(NO3)3
8. Задание {{ 311 }} ТЗ № 311
Гидролизу по катиону в водном растворе подвергаются соли
- NaCl
+ (NH4)2SO4
+ CuCl2
- K2CO3
9. Задание {{ 312 }} ТЗ № 312
Гидролизу по аниону в водном растворе подвергается соль
- AlCl3
+ Na2S
- (NH4)2S
- Al2S3
- CuCl2
10. Задание {{ 313 }} ТЗ № 313
В водном растворе и по катиону и по аниону гидролизуются соли
- NaNO3
+ CH3COONH4
+ (NH4)2CO3
- KCl
- CuCl2
11. Задание {{ 314 }} ТЗ № 314
Гидролиз хлорида алюминия можно усилить
+ повышением температуры
- увеличением концентрации соли
- подкислением раствора
+ подщелачиванием раствора
 12. Задание {{ 315 }} ТЗ № 315
12. Задание {{ 315 }} ТЗ № 315
Равновесие реакции гидролиза S2- + HOH HS- + OH- можно сместить вправо, если
+ добавить кислоты
- добавить щелочи
- охладить раствор
+ нагреть раствор
+ добавить воды
13. Задание {{ 316 }} ТЗ № 316
Наиболее сильно гидролизу подвергается соль калия
- KNO3
+ K2S
- K2Se
- K2Te
- KCl
14. Задание {{ 317 }} ТЗ № 317
Концентрация гидроксидных ионов наибольшая в водном растворе соли
- NaNO3
+ Na2CO3
- CuSO4
- BaCl2
15. Задание {{ 318 }} ТЗ № 318
Подкисление раствора ослабляет гидролиз солей
+ CuSO4
- Na2CO3
- Na2S
+ NH4Cl
16. Задание {{ 319 }} ТЗ № 319
В водном растворе NaCl реакция среды
- кислая
- щелочная
+ нейтральная
17. Задание {{ 320 }} ТЗ № 320
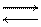
В водном растворе Na2CO3 pH
+ >7
- <7
- 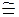 7
7
18. Задание {{ 321 }} ТЗ № 321
К щелочной среде приведет добавление к воде
- NaCl
- AlCl3
- HCl
+ K2CO3
- CO2
19. Задание {{ 322 }} ТЗ № 322
При растворении в воде слабощелочную реакцию дает
- H2S
- SO2
- CO2
+ NH3
- NaCl
20. Задание {{ 323 }} ТЗ № 323
Раствор нитрата железа (III) имеет реакцию среды
+ кислую
- щелочную
- нейтральную
21. Задание {{ 324 }} ТЗ № 324
Ослабить или прекратить гидролиз раствора хлорида аммония можно добавив немного
- KOH
- NaCl
+ HCl
- H2O
- KNO3
22. Задание {{ 325 }} ТЗ № 325
Чтобы ослабить или прекратить гидролиз раствора Na2СO3 необходимо добавить немного
+ KOH
- NaCl
- HCl
- H2O
- KNO3
23. Задание {{ 326 }} ТЗ № 326
В водном растворе (NH4)2S
+ pH 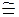 7
7
- pH>7
- pH<7
24. Задание {{ 327 }} ТЗ № 327
В водном растворе CuCl2
- pH 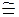 7
7
- pH>7
+ pH<7
25. Задание {{ 328 }} ТЗ № 328
Щелочной раствор получают при растворении в воде
- SO2
- CO2
- CaCl2
+ K2SO3
- CuSO4
26. Задание {{ 329 }} ТЗ № 329
Гидролиз раствора FeCl3 усилится при добавлении
- NH4Cl
+ H2O
- HCl
- ZnCl2
- NaCl
27. Задание {{ 330 }} ТЗ № 330
Степень гидролиза можно рассчитать по формулам
+ 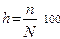
- 
- h= 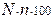
+ N = 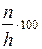
28. Задание {{ 331 }} ТЗ № 331
Лакмус синий в водном растворе
- KCl
+ K2SO3
- CuCl2
- NH4Cl
- HCl
29. Задание {{ 332 }} ТЗ № 332
Лакмус красный в водных растворах
- KCl
- K2SO3
+ CuCl2
+ NH4Cl
+ HCl
30. Задание {{ 333 }} ТЗ № 333
Лакмус фиолетовый в водном растворе
+ KCl
- K2SO3
- CuCl2
- NH4Cl
- HCl
31. Задание {{ 334 }} ТЗ № 334
Гидролиз Al2S3 протекает
- обратимо
+ необратимо
- ступенчато
32. Задание {{ 335 }} ТЗ № 335
Гидролизу не подвергаются соли
- CuSO4
+ NaCl
+ KNO3
- K2CO3
- (NH4)2S
33. Задание {{ 336 }} ТЗ № 336
Гидролиз хлорида меди усиливается при
- подкислении раствора
+ добавлении воды
+ нагревании раствора
+ подщелачивании раствора
34. Задание {{ 337 }} ТЗ № 337
Для солей образованных слабым основанием и слабой кислотой константа гидролиза рассчитывается по формуле
- Кг = 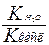
- Кг = 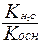
+ Кг = 
35. Задание {{ 338 }} ТЗ № 338
Для солей образованных слабым основанием и сильной кислотой константа гидролиза рассчитывается по формуле
- Кг = 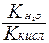
+ Кг = 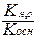
- Кг = 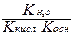
36. Задание {{ 339 }} ТЗ № 339
Для солей образованных сильным основанием и слабой кислотой константа гидролиза рассчитывается по формуле
+ Кг = 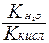
- Кг = 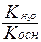
- Кг = 
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 720; Нарушение авторских прав?; Мы поможем в написании вашей работы!