
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическая часть. Равновесные электродные процессы
|
|
|
|
И КОНЦЕНТРАЦИОННЫХ ЭЛЕМЕНТОВ
ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ ХИМИЧЕСКИХ
Равновесные электродные процессы
Возникновение электродного потенциала. Уравнение Нернста
Растворы, обладающие электрической проводимостью (электролиты), по своим свойствам существенно отличаются от растворов неэлектролитов. Отличительной особенностью электролитов является наличие ионов (т.е. частиц, обладающих избыточным электрическим зарядом) в растворе. Наличие ионов приводит не только к существенному отклонению свойств растворов электролитов по сравнению с растворами неэлектролитов, но и приводит к совокупности новых свойств и явлений. При рассмотрении термодинамических систем, участниками которых являются ионы, необходимо учитывать кроме механической работы электрическую работу, связанную с переносом заряженных частиц.
Таким образом, в системах, состоящих из проводников первого рода (обладающих электронной проводимостью), находящихся в контакте с проводниками второго рода (обладающих ионной проводимостью), происходит взаимное превращение химической и электрической форм энергий. Такая система называются электродом.
Проводники первого рода — это, как правило, металлы, проводники второго рода — электролиты. Перенос заряда через границу раздела фаз (электрический ток) в электроде осуществляется за счет электрохимической реакции.
Объединив все постоянные величины в одну величину — φ °, которая называется стандартным электродным потенциалом, получим выражение для разности потенциалов между фазами, составляющими электрод:
 (3.1)
(3.1)
Полученное уравнение называется уравнением Нернста.
Стандартный электродный потенциал — это величина, характерная для каждого электродного процесса, которая также зависит от температуры и природы растворителя. Уравнение Нернста связывает величину разности потенциалов между фазой раствора электролита и фазой проводника первого рода с активностями компонентов, участвующих в электродной реакции.
Для обратимой электродной реакции окисленная форма вещества переходит в восстановленную форму и наоборот
 , (3.2)
, (3.2)
тогда уравнение Нернста будет выглядеть
 , (3.3)
, (3.3)
где  — число электронов, участвующих в электрохимической реакции,
— число электронов, участвующих в электрохимической реакции,  — активность окисленной формы вещества,
— активность окисленной формы вещества, 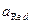 — активность восстановленной формы вещества и φ° — стандартный потенциал электродной реакции.
— активность восстановленной формы вещества и φ° — стандартный потенциал электродной реакции.
В более общем случае для реакции на электроде
 можно записать:
можно записать:
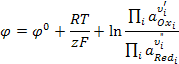 . (3.4)
. (3.4)
Например, для обратимого перехода металла М в его ионную форму в растворе можно записать:
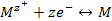 (3.5)
(3.5)
Запишем для нашей реакции уравнение Нернста:
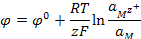 , (3.6)
, (3.6)
где 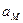 и
и 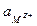 — активности металла и иона этого металла на электроде и в растворе соответственно. В связи с тем, что активность металла остается постоянной, так как металл образует отдельную фазу чистого компонента, а ее значение зависит от выбора стандартного состояния, ам тоже можно включить в стандартный потенциал φ°. Обычно за стандартное cостояние принимают состояние чистого компонента при стандартном давлении (симметричная система отсчета химического потенциала). В этом случае, согласно выражению (3.2), активность металла будет равной единице, и уравнение Нернста для рассматриваемого случая предстанет в следующем виде:
— активности металла и иона этого металла на электроде и в растворе соответственно. В связи с тем, что активность металла остается постоянной, так как металл образует отдельную фазу чистого компонента, а ее значение зависит от выбора стандартного состояния, ам тоже можно включить в стандартный потенциал φ°. Обычно за стандартное cостояние принимают состояние чистого компонента при стандартном давлении (симметричная система отсчета химического потенциала). В этом случае, согласно выражению (3.2), активность металла будет равной единице, и уравнение Нернста для рассматриваемого случая предстанет в следующем виде:
 . (3.7)
. (3.7)
Следует отметить, что в общем случае при записи уравнения Нернста под логарифмом остаются только те величины, которые могут варьироваться. Таким образом, при записи уравнения Нернста для разных случаев необходимо соблюдать несколько правил, связанных с применением выражения (3.2) для различных типов растворов и выбором стандартного состояния для чистых компонентов и растворителя:
1. Активности чистых компонентов, образующих отдельную фазу постоянного состава, (как правило, это твердые вещества) принимаются равными единице;
2. Активность растворителя принимается равной единице;
3. Вместо активностей газообразных веществ в уравнение входят относительные парциальные давления этих газов над раствором. Давление приводится относительно стандартного (1.01· 105 Па), т. о. эта величина является безразмерной, хотя численно она совпадает с парциальным давлением газа, выраженным в атмосферах (атм). Использование парциальных давлений справедливо для случая не очень высоких давлений (порядка нескольких атмосфер). В случае высоких давлений необходимо использовать фугитивности газов.
В настоящее время нет прямых экспериментальных и расчетных методов определения отдельных скачков потенциала на границе раздела фаз в электроде. Поэтому значение абсолютного потенциала электрода в современной физической химии не определяется. Значение потенциала электрода определяется относительно потенциала какого-либо стандартного электрода. Переход к условной шкале потенциалов позволяет избавиться от многих трудностей и неопределенностей при решении большинства электрохимических задач.
Правила схематической записи электродов
При схематической записи электрохимических систем и уравнений, протекающих в них реакций необходимо соблюдать следующие основные правила.
1. Для электродов (полуэлементов): вещества, находящиеся в растворе (можно только потенциалопределяющие ионы), указываются слева от вертикальной черты, справа указываются вещества, образующие другую фазу, или материал электрода.
2. Если в растворе находится несколько веществ, то они разделяются запятыми.
Вещества, составляющие различные фазы разделяются с помощью вертикальной черты. Например:
Cd2+|Cd
Cl-|AgCl|Ag+
Н+|Н2 |Pt
3. Уравнение электродной реакции записывается так, чтобы слева располагались вещества в окисленной форме и электроны, а справа вещества в восстановленной форме:
Cd2+ + 2e- ↔ Cd
AgCl + e- ↔ Ag + Сl-
2H+ + 2e- ↔ H2
Классификация электродов
В различных учебниках можно найти разные классификации электродов. Однако, здесь приведена классификация электродов рекомендованная ИЮПАК (Международный союз теоретической и прикладной химии).
Электроды нулевого рода (окислительно- восстановительные электроды)
Окислитель и восстановитель, как правило, находятся в растворе, а фаза проводника первого рода выполнена из инертного материала (например, Pt), которая выступает в качестве контакта и не участвует в электрохимической реакции.
Ox,Red|Pt
Ox + ze- ↔ Red.
Примеры:
Fe2+ ,Fe3+ Pt;
С6Н402, С6Н4(ОН)2, Н+|Pt (хингидронный электрод).
Электроды первого рода
1.Металл, погруженный в раствор, содержащий ионы этого металла Mz+ |М.
2.Неметалл, погруженный в раствор, содержащий ионы этого неметалла Az- |A.
Металлическая фаза может быть выполнена не только из чистого вещества, но представлять собой сплав (раствор). Например, амальгамные электроды (амальгама — раствор металла в ртути)
Mz-|M(Hg)
 , (3.8)
, (3.8)
где  — активность металла в амальгаме.
— активность металла в амальгаме.
Электроды второго рода
Электрод второго рода обратим относительно иона (В-) (т. е. его потенциал зависит от концентрации этого иона), образующего с потенциалопределяющим ионом (А+) малорастворимое соединение (АВ) и находящегося при этом в избытке.
В-| АВ | А
АВ + е- ↔ А + B-
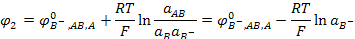 (3.9)
(3.9)
Примеры:
Сl-| AgCl | Ag —хлоридсеребряный электрод; Сl- | Hg2Cl2| Hg — каломельный электрод.
Электроды второго рода часто используются в лабораторной практике как электроды сравнения, это связано с надежностью их работы, хорошей воспроизводимостью потенциала и простотой изготовления.
Электроды третьего рода
Электрод третьего рода обратим относительно избытка катиона (С+), который образует с анионом (В-) малорастворимое или комплексное соединение (СВ), образующего, в свою очередь, с потенциалопределяющим ионом (А+) малорастворимое или комплексное соединение (АВ).
C+|CB|AB|A
С+ + АВ + е- ↔ А + СВ.
 . (3.10)
. (3.10)
Примеры:
Hg2+|Hg2Cl2|AgCl|Ag;
Са2+ |СаЭДТА2- |НgЭДТА2- |Hg.
Газовые электроды
Газовые электроды выделяет по признаку того, что один из участников окислительно-восстановительной пары находится в газовой фазе.
Примеры:
Н+|Н2, Pt — водородный электрод; Сl- | С12| Pt —хлорный электрод.
Ион-селективные электроды
Ион-селективные электроды основаны на использовании специальных мембран, способных пропускать специфические ионы. Они обратимы относительно этих ионов, находящихся в растворе.
Наибольшее применение в практике получили фтор-селективный и стеклянный электроды.
Стеклянный электрод изготавливается на основе мембран из специальных сортов стекла. Например, стеклянная мембрана разделяет внешний раствор, содержащий ионы водорода, и внутренний стандартный раствор соляной кислоты, в котором, в свою очередь, находится хлорид-серебряный электрод:
Н+| стекло | НС1| AgCl | Ag
Потенциал стеклянного электрода зависит от активности ионов водорода:
 (3.11)
(3.11)
Обычно 2.3RT/F объединяют в специальную переменную b.
b=2.3RT/F=0.059B (298K).
Следует обратить внимание, что b не является константой, так как она зависит от температуры.
На использовании стеклянного электрода основан метод рН-метрии.
Гальванические элементы
Из двух электродов может быть составлена электрохимическая цепь — гальванический элемент, в которой электрическая энергия вырабатывается за счет протекания электрохимических реакций на электродах. Условие работы такого элемента – разделение единого процесса на процесс окисления и процесс восстановления, протекающие на различных пространственно разделенных электродах. Оба электрода находятся в электролите (проводник второго рода) и замыкаются через внешнюю цепь (проводник первого рода).
Отдельный электрод в гальваническом элементе иногда называют полуэлементом. Основной электрической характеристикой электрохимической цепи является разность электрических потенциалов между электродами.
Разность потенциалов, наблюдаемая между электродами гальванического элемента при разомкнутой внешней цепи, называется электродвижущей силой 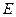 . Электродвижущая сила ЭДС гальванического элемента определяется величиной свободной энергии токообразующего процесса и не зависит от конструкции элемента и величины электродов.
. Электродвижущая сила ЭДС гальванического элемента определяется величиной свободной энергии токообразующего процесса и не зависит от конструкции элемента и величины электродов.
Если токообразующий процесс провести в обратимых условиях, то элемент произведет максимальную работу:
 (3.12)
(3.12)
или в калориях  .
.
Зависимость максимальной работы химической реакции  от теплоты реакции
от теплоты реакции  при постоянном давлении выражается уравнением Гиббса-Гельмгольца:
при постоянном давлении выражается уравнением Гиббса-Гельмгольца:
 . (3.13)
. (3.13)
Из уравнений (3.12) и (3.13) получаем
 . (3.14)
. (3.14)
Величина  представляет собой температурный коэффициент ЭДС элемента и приближенно может быть определена из выражения
представляет собой температурный коэффициент ЭДС элемента и приближенно может быть определена из выражения
 , (3.15)
, (3.15)
где  и
и  - значения ЭДС элемента соответственно при температурах
- значения ЭДС элемента соответственно при температурах  и
и 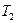 .
.
Равенство (3.15) оказывается тем точнее, чем меньше отличаются между собой  и
и 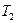 , так как зависимость
, так как зависимость 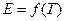 только в узком интервале температур близка к линейной.
только в узком интервале температур близка к линейной.
Зная значения 
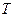 и
и 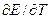 , по уравнению (3.14) нетрудно вычислить теплоту реакции и, наоборот, зная
, по уравнению (3.14) нетрудно вычислить теплоту реакции и, наоборот, зная  и измерив
и измерив 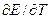 , можно определить величину максимальной работы и ЭДС элемента. Если
, можно определить величину максимальной работы и ЭДС элемента. Если 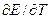
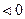 , то
, то  , то есть часть тепла при работе элемента выделяется в окружающую среду и элемент, находясь в адиабатических условиях, нагревается.
, то есть часть тепла при работе элемента выделяется в окружающую среду и элемент, находясь в адиабатических условиях, нагревается.
При схематической записи электрохимической цепи:
1. Левый электрод записывается в обратном порядке (вещества, находящиеся в растворе, указываются справа от вертикальной черты, слева указываются вещества, образующие другую фазу, или материал электрода). Правый электрод записывается в обычном порядке согласно правилам схематической записи электродов;
2. Растворы обоих электродов отделяются вертикальной пунктирной линией, если они контактируют друг с другом (диффузионный потенциал не устранен) или двумя сплошными вертикальными линиями, если диффузионный потенциал между растворами устранен (например, с помощью солевого мостика).
Разность электрических потенциалов равна по знаку и значению электрическому потенциалу металлического проводника, присоединенного к правому электроду, минус потенциал идентичного проводника, присоединенного к левому электроду.
 , (3.16)
, (3.16)
где φп — потенциал правого электрода, φл—потенциал левого.
Согласно правилу записи электродной реакции, для каждого электрода окисленная форма вещества и электроны записываются слева. Суммарная реакция, протекающая в элементе, является разницей между реакциями на правом и левом электродах. Тогда, если разность потенциалов всего элемента положительна, то суммарная реакция и электрический ток в гальваническом элементе протекает слева направо, если же отрицательно, то — в обратном направлении.
Рассмотрим в качестве примера три случая.
1.Оба электрода имеют общий раствор;
Cd|CdCl2|AgCl|Ag
На электродах протекают реакции:
(1) AgCl + e↔Ag + Cl-;
(2) Cd2+ + 2e-↔ Cd.
Суммарная реакция, протекающая в элементе
AgCl + 0.5Cd ↔ Ag + 0.5CdCl2.
2. Растворы электродов различны и имеют контакт между собой через мембрану (диффузионный потенциал не устранен);
Cd | Cd(N03)2¦ NaCl | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + е-↔ Ag + Сl-
(2) Cd2+ + 2e- ↔Cd
Суммарная реакция, формально протекающая в элементе
AgCl + 0.5Cd ↔ Ag + 0.5Cd2+ + Cl-.
3. Растворы электродов различны и соединены между собой солевым мостиком (диффузионный потенциал устранен).
Pt, Н2|НС1 || NaCl | AgCl |Ag
На электродах протекают реакции:
(1) AgCl + е- ↔ Ag + Cl-
(2) 2Н+ + 2е- ↔ Н2.
Суммарная реакция, формально протекающая в элементе
AgCl + 0.5H2 ↔ Ag + H+ + Cl-.
УСЛОВНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
ЭДС гальванического элемента складывается из скачков потенциала на границе всех фаз образующих элемент. При этом в формировании ЭДС гальванического элемента могут участвовать не только разницы потенциалов между фазами электродов, но и разница потенциалов между металлами образующими электронопроводящую фазу электродов — так называемый контактный потенциал, а также разница потенциалов между фазами растворов электродов — диффузионный потенциал.
Диффузионный потенциал возникает на границе двух растворов из-за различных подвижностей ионов, содержащихся в электродных растворах и/или их концентраций. Гальванический элемент может иметь общий раствор электролита для обоих электродов. В этом случае диффузионный потенциал будет отсутствовать. В других случаях при проведении электрохимических измерений от диффузионного потенциала стараются по возможности избавиться. Существует несколько способов устранения диффузионного потенциала. Наиболее простым является использование для соединения растворов двух электродов солевого мостика, заполненного раствором соли, катионы и анионы которой обладают приблизительно одинаковыми подвижностями (КСl, KNO3).
Контактный потенциал возникает в случае, когда электронопроводящие фазы электродов выполнены из различных металлов. В связи с тем, что в настоящее время нет прямых экспериментальных и расчетных методов определения отдельных скачков потенциала на границе раздела фаз в гальваническом элементе, значение потенциала отдельных электродов приводят относительно потенциала какого-либо стандартного электрода — переход к условной шкале потенциалов. В этом случае при расчете ЭДС гальванического элемента компенсируется как сдвиг потенциалов отдельных электродов относительно абсолютной шкалы потенциалов, так и контактный потенциал1, который входит в условный стандартный электродный потенциал.
Принято выражать потенциалы электродов относительно стандартного водородного электрода (условная водородная шкала потенциалов), потенциал которого принят за ноль при всех температурах. Для определения электродного потенциала электрода составляется гальванический элемент из этого электрода и стандартного водородного электрода —
Н+ || Н2, Pt (активность иона водорода поддерживается равной единице и парциальное давление водорода над раствором — 1.013·105 Па). Переход к условной шкале потенциалов позволяет избавиться от многих трудностей и неопределенностей при решении большинства электрохимических задач.
Согласно правилам ИЮПАК условный электродный потенциал или просто электродный потенциал определяется как ЭДС элемента, в котором слева расположен стандартный водородный электрод, а справа — рассматриваемый электрод.
Например, потенциал кадмиевого электрода (Cd2+| Cd) будет равен ЭДС элемента
Pt|H2|H+||Cd2+|Cd.
Потенциал рассматриваемого электрода обозначается при этом символом 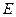 . В справочниках приводятся условные стандартные потенциалы электродов при некоторой температуре, которые измерены относительно стандартного водородного электрода при соотношении активностей веществ, участвующих в электродной реакции, равном единице.
. В справочниках приводятся условные стандартные потенциалы электродов при некоторой температуре, которые измерены относительно стандартного водородного электрода при соотношении активностей веществ, участвующих в электродной реакции, равном единице.
Тогда, для рассмотренного примера, потенциал кадмиевого электрода будет записан как
 , (3.17)
, (3.17)
где 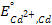 — стандартный электродный потенциал кадмиевого электрода.
— стандартный электродный потенциал кадмиевого электрода.
Запись и порядок применения уравнения Нернста сохраняется при переходе к условной шкале потенциалов с заменой  на
на  .
.
Тогда уравнение Нернста для условной шкалы потенциалов запишется в виде:
 (3.18)
(3.18)
Выражения для ЭДС гальванического элемента через условные потенциалы будет
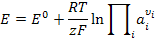 (3.19)
(3.19)
где  — потенциал правого электрода,
— потенциал правого электрода,  — потенциал левого электрода.
— потенциал левого электрода.
Разница между стандартными потенциалами электродов гальванического элемента называется стандартным ЭДС данного гальванического элемента и обозначается 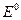 . Для рассмотренных выше примеров гальванических элементов можно записать выражения для ЭДС.
. Для рассмотренных выше примеров гальванических элементов можно записать выражения для ЭДС.
l.Cd|CdCl2|AgCl|Ag
ЭДС этого элемента
 (3.20)
(3.20)
где 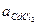 - средняя активность раствора CdCl2.
- средняя активность раствора CdCl2.
2. Cd|Cd(NO3)2¦NaCl|AgCl|Ag
ЭДС этого элемента
 , (3.21)
, (3.21)
где  - активность ионов хлора в растворе первого электрода,
- активность ионов хлора в растворе первого электрода,  - активность ионов кадмия в растворе второго электрода.
- активность ионов кадмия в растворе второго электрода.
3. Pt, H2|HCl¦NaCl|AgCl|Ag
ЭДС этого элемента
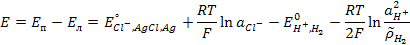 , (3.22)
, (3.22)
где 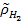 - относительное парциальное давление водорода над раствором второго электрода,
- относительное парциальное давление водорода над раствором второго электрода,  - активность ионов хлора в растворе первого электрода,
- активность ионов хлора в растворе первого электрода,  - активность ионов водорода в растворе второго электрода.
- активность ионов водорода в растворе второго электрода.
ТИПЫ ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
Химические цепи
Гальванические элементы первого типа — химические цепи -представляют собой элементы, составленные из электродов, на которых протекают различные электрохимические реакции.
Например,
Cu|CuCl2|AgCl|AgCd|CdCl2¦NaBr|AgBr|Ag
Концентрационные цепи
Гальванические элементы второго типа — концентрационные цепи — представляют собой элементы, составленные из электродов, на которых протекают одинаковые химические реакции, но концентрации реагирующих веществ на электродах различны.
Например,
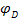
Cu|CuS04¦CuS04|Cu
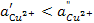 ,
,
где  и
и 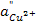 — различные активности ионов меди на электродах,
— различные активности ионов меди на электродах, 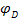 — диффузионный потенциал, возникающий на границе растворов. Запишем потенциалы обоих электродов:
— диффузионный потенциал, возникающий на границе растворов. Запишем потенциалы обоих электродов:
 (3.23)
(3.23)
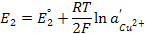 (3.24)
(3.24)
Тогда ЭДС элемента будет
 . (3.25)
. (3.25)
Как правило, различие в концентрациях веществ на разных электродах концентрационных элементов мало, поэтому диффузионный потенциал вносит существенный вклад в общую ЭДС.
С учетом диффузионного потенциала ЭДС гальванического элемента обратимого относительно катиона будет
 , (3.26)
, (3.26)
где t+ — число переноса катионов, v — число формульных частиц анионов, составляющих данный электролит, t_ — число переноса анионов, v — общее число формульных частиц, составляющих данный электролит, v+, v-—число формульных частиц катионов и анионов, составляющих данный электролит.
ЭДС гальванического элемента обратимого относительно аниона будет
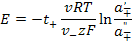 (3.27)
(3.27)
ЭДС гальванического элемента определяется уравнением Нернста только в условиях обратимого протекания в нем процессов. Это соответствует протеканию через элемент бесконечно малого тока (бесконечно медленное проведение процессов). Поэтому измерение ЭДС электрохимических цепей стремятся проводить в условиях, когда ток через элемент не протекает или этот ток бесконечно мал. В условиях протекания через гальванический элемент значительных токов происходит существенное уменьшение ЭДС элемента, которое определяется многими факторами, в том числе, кинетикой электродных реакций и условиями диффузии веществ внутри элемента. Для измерения ЭДС электрохимических цепей пользуются компенсационной схемой или потенциометрами с достаточно большим входным сопротивлением (сотни МОм).
Потенциометрия
Потенциометрия — метод исследования, в основе которого лежат термодинамические соотношения между ЭДС электрохимических цепей, с одной стороны, и физико-химическими параметрами растворов и химичеких реакций с другой. Потенциометрию используют для определения
— рН растворов,
— констант гидролиза солей,
— констант диссоциации кислот и оснований,
— произведений растворимости малорастворимых соединений,
— констант устойчивости комплексов,
— коэффициентов активности ионов в растворах,
— термодинамических характеристик химических реакций
и т.д.
Ионное равновесие в растворе характеризуется соответствующими термодинамическими константами. Например, для малорастворимого соединения, диссоциирующего по уравнению
 (3.28)
(3.28)
равновесие характеризуется произведением растворимости:
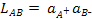 . (3.29)
. (3.29)
Для определения произведения растворимости можно составить гальванический элемент
А | АВ | DB || АС | А,
где АС и DB — хорошо растворимые соли соответствующего катиона (А+) и аниона (В-), А+1А — электрод первого рода, а В- | АВ, А — электрод второго рода. На электродах будут протекать следующие реакции:
(1) 
(2)  (3.30)
(3.30)
Запишем уравнение Нернста для этих электродов.
Электрод второго рода можно представить как электрод первого рода, только с очень малой концентрацией иона металла, которая будет зависеть от концентрации аниона, образующего с ним малорастворимое соединение. Тогда, учитывая выражение для произведения растворимости, получим
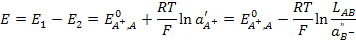 . (3.31)
. (3.31)
Выражение для ЭДС этого элемента будет
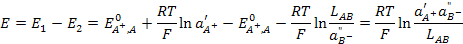 . (3.32)
. (3.32)
Таким образом, произведение растворимости малорастворимого соединения связано с ЭДС рассмотренного элемента, и для его определения необходимо измерить ЭДС элемента при известных активностях иона металла (А+) в растворе первого электрода и аниона (В-) в растворе второго.
Для определения других термодинамических констант необходимо составлять соответствующие электрохимические цепи и измеряя их ЭДС при известных активностях потенциалопределяющих веществ вычислять значение констант.
3.2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Контрольные вопросы
1. Перечислите правила схематической записи электрохимических цепей. Приведите примеры.
2. Что представляет собой условный стандартный электродный потенциал электрохимического процесса? Как экспериментально можно определить его значение?
3. В чем заключается порядок выполнения работы?
4. Выразите значение произведения растворимости исследуемой соли от потенциала используемой электрохимической цепи и активностей потенциалопределяющих веществ.
5. Как определить произведение растворимости исследуемой соли графическим методом? В каких координатах должна наблюдаться линейная зависимость?
6. Как можно учесть неидеальность раствора при переходе от концентрации иона к его активности. Как определяется ионная сила раствора. Как необходимо изменить координаты графика, чтобы учесть изменение ионной силы растворов?
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 4937; Нарушение авторских прав?; Мы поможем в написании вашей работы!