
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Работа №1
|
|
|
|
Определение произведения растворимости
малорастворимых солей
Цель
Определить произведение растворимости малорастворимых солей серебра методом потенциометрии.
Задачи
1. Убедится в чистоте ячейки и электродов;
2. Измерить ЭДС гальванических элементов с различной концентрацией солей;
3. Рассчитать значение произведения растворимости исследуемой соли, полученной при различных измерениях;
4. Усреднить полученные значения и сравнить с данными приведенными в справочной литературе.
Приборы и реактивы
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации:
— центральный контроллер;
— модуль «Электрохимия» в комплекте с двумя стаканчиками (50 см3), двумя серебряными электродами, электролитическим мостиком и двумя шнурами для подсоединения электродов;
2. Растворы AgN03 и растворы галогенидов щелочных металлов 0.01 М, агар-агар, дистиллированная вода;
3. Две пипетки на 10 см3, лабораторная посуда.
Методика выполнения работы и ее обоснование
Для определения произведения растворимости какого-либо галогенида серебра необходимо составить гальванический элемент, в котором в качестве одного электрода используется электрод 1-го рода, другим электродом служит электрод II-го рода с осадком исследуемого соединения на электроде
Ag|AgX|KX||AgN03(aq)|Ag,
где 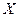 — соответствующий галоген (CI, Вг или I). На электродах будут протекать следующие реакции:
— соответствующий галоген (CI, Вг или I). На электродах будут протекать следующие реакции:
(1) Ag+ e- ↔ Ag,
(2) AgX + e- ↔ Ag + X-.
Суммарная реакция, протекающая в электрохимическом элементе, соответствует реакции образования исследуемого малорастворимого соединения из ионов:
Ag+ + X- ↔ AgX.
Запишем уравнения Нернста для этих электродов.
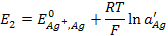 (3.33)
(3.33)
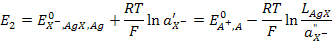 , (3.34)
, (3.34)
где 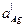 и
и 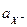 — активности ионов серебра и галогенид-иона в растворах первого и второго электродов, соответственно,
— активности ионов серебра и галогенид-иона в растворах первого и второго электродов, соответственно, 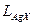 − произведение растворимости AgX.
− произведение растворимости AgX.
Выражение для ЭДС этого элемента будет
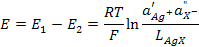 . (3.35)
. (3.35)
Таким образом, произведение растворимости малорастворимого соединения связано с ЭДС рассмотренного элемента, и для его определения необходимо измерить ЭДС элемента при известных активностях иона серебра (Ag+) в растворе первого электрода и аниона 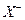 в растворе второго.
в растворе второго.
Практически рассмотренный гальванический элемент составляют из двух частей, каждая из которых представляет собой соответствующий электрод. Электроды соединяются электролитическим мостиком заполненным раствором KN03 с агар-агаром. В связи с тем, что подвижности ионов калия и нитрат-ионов близки, величина диффузионного потенциала не будет существенно влиять на результаты измерений. Первоначально обе части элемента заполняют раствором AgN03 для того, чтобы проверить правильности приготовления электродов. Затем, раствор из одной части заменяют раствором галогенида калия (не промывая при этом стаканчик) и он приобретает свойства электрода второго рода.
Для небольших концентраций ионов в растворе (менее 0.01 М) и отсутствии посторонних ионов можно принять активности ионов равными их концентрациям и проводить расчеты без учета коэффициентов активности.
Для проведения работы предварительно готовят растворы галогенидов (КС1, КВг или KJ — в зависимости от того произведение какого галогенида серебра необходимо определить) концентрации 0.01 М и раствор AgN03 той же концентрации (слегка подкисленный азотной кислотой для предотвращения гидролиза). Следует помнить, что раствор нитрата серебра плохо хранится и для проведения работы необходимо использовать его свежеприготовленным.
Порядок выполнения работы
1. Перед проведением первого опыта поверхность серебрянных электродов осторожно, но тщательно очищают лезвием от оксидов или сульфидов серебра, которые могли образоваться при хранении электродов. Вместо механической очистки можно обработать электрод концентрированным раствором аммиака (несколько минут).
2. Тщательно вымытый стаканчик на 50 см3 устанавливают в штатив модуля и помещают в него с помощью пипетки 20 см3 раствора соляной кислоты. В стаканчик вносят несколько капель раствора нитрата серебра для создания раствора насыщенного относительно ионов серебра (I) (это необходимо для получения хлоридсеребряного электрода, обратимого относительно хлорид-ионов). Далее в стаканчике устанавливают: серебряный и стеклянный электроды и один термодатчик.
3. Подключение электродов и термодатчика производят согласно схеме.
4. Производят измерение ЭДС гальванического элемента и заносят полученное значение в таблицу.
5. Из одного из стаканчиков выливают раствор нитрата серебра, и не промывая наливают в него 20 см3 подготовленного раствора галогенида калия.
6. Производят измерение ЭДС гальванического элемента и заносят полученное значение в таблицу.
7. Производят разбавление раствора галогенида в 2 раза. Для этого отбирают пипеткой 10 см3 раствора и помещают вместо него 10 см3 дистиллированной воды (используют разные пипетки для раствора и воды) с последующим измерением ЭДС и заносят полученное значение в таблицу.
8. Повторяют разбавление с последующим измерением ЭДС 2-3 раза и заносят полученное значение в таблицу.
9. Производят расчет произведения растворимости для разных концентраций галогенид ионов по уравнению (1), усредняют и сравнивают с данными справочной литературы, заносят в таблицу.
Рекомендуемый вид таблицы
| СКХ, M | E,B | 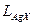
|
Справочные данные (для сравнения):
ПрAgCl=1,73·10-10 г·ион/л (t0=250C)
ПрAgВг=5·10-13 г·ион/л (t0=250C)
ПрAgJ=8,1·10-17 г·ион/л (t0=250C)
Работа № 2.
Определение значений водородного показателя (рН) ВОДНЫХ растворов
Цель
Определить значения рН ряда водных растворов методом потенциометрии с использованием стеклянного и хингидронного электродов.
Задачи
1. Измерить ЭДС двух гальванических элементов с растворами, рН которых известна (буферные растворы), составленных из стеклянного и хлоридсеребряного электродов и хингидронного и хлоридсеребряного электродов (время установления равновесия – 5 мин.);
2. Построить график зависимости ЭДС от рН;
3. Измерить ЭДС этих гальванических элементов с различными растворами, рН которых не известна;
4. Определить графически значения рН исследованных растворов и сравнить значения, полученные с использованием стеклянного и хингидронного электродов.
Приборы и реактивы
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации:
— центральный контроллер;
— модуль «Электрохимия» в комплекте с двумя стаканчиками (50 см3), датчиком температуры, стеклянным, хлоридсеребряным, платиновым или золотоуглеродистым электродами и шнурами для подсоединения электродов;
3. Буферные растворы с известным значением рН и растворы, рН которых требуется определить, хингидрон, дистиллированная вода.
Методика выполнения работы и ее обоснование
В настоящее время кислотность среды принято выражать с помощью водородного показателя (рН). Водородный показатель это отрицательный десятичный логарифм активности иона водорода в растворе.
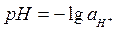 (3.36)
(3.36)
Так как ионное произведение воды KW = [aH]· [aOH]· =10-14 при 298 К, то при значениях рН < 7 ионов водорода будет больше, чем гидроксид-ионов и говорят, что среда кислая. Если же значение рН > 7, то соответственно, говорят, что среда щелочная.
Стеклянный электрод — ион-селективный электрод селективный по отношению к ионам водорода находящимся в растворе. Потенциал стеклянного электрода зависит от активности ионов водорода следующим образом:
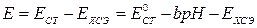 (3.37)
(3.37)
Напомним, что b = 2,3RT/F.
Для определения рН некоторого раствора составляют цепь, состоящую из стеклянного электрода, погруженного в исследуемый раствор, и электрода сравнения, потенциал которого сохраняется постоянным в ходе эксперимента. В современной практике в качестве электрода сравнения обычно используется насыщенный хлоридсеребряный электрод (ХСЭ).
Ag | AgCl | исследуемый раствор | стекло | НС1(0.1 М) | AgCl | Ag,
Тогда мы можем записать ЭДС всей цепи
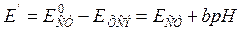 . (3.38)
. (3.38)
Следовательно, потенциал такого элемента будет линеен относительно значения рН. Зная потенциал элемента, содержащего раствор с известным значением рН, можно рассчитать значение всех постоянных величин, входящих в уравнение. В нашем случае — это стандартный потенциал стеклянного электрода и потенциал ХСЭ. Обозначим их разницу как Е' и выразим через потенциал элемента и значение рН раствора.
Для экспериментального определения Е' используют буферные растворы с приписанными значениями рН. Составы буферных растворов и приписанное им значение рН можно найти в справочной литературе. Промышленностью выпускаются стандарт-титры для приготовления буферных растворов.
Применяемые для рН-метрии стеклянные электроды, имеют линейную характеристику в довольно широких диапазонах температур и значений рН. Например, электрод ЭСЛ-43-07 имеет линейную характеристику в диапазоне значений рН от 0 до 12 (при 298 К).
Для проведения работы следует приготовить буферный раствор с известным значением рН (лучше со значением рН около 4) и ряд растворов с различными значениями рН в диапазоне от 1 до 7 (растворы можно приготовить разбавлением растворов сильных кислот — серной или соляной).
Порядок выполнения работы
1. Тщательно вымытый стаканчик на 50 см3 устанавливают в штатив модуля и наливают в него примерно 40 см3 заранее приготовленного буферного раствора (рекомендуется стаканчик и электроды предварительно ополоснуть буферным раствором). Стаканчик закрывают крышкой и устанавливают стеклянный и хлоридсеребряный электроды и термодатчик.
2. Подключение электродов и термодатчика производят согласно электрической схеме.
3. После установления равновесия (равновесие устанавливается в течение 3-5 минут) производят измерение ЭДС, составленного гальванического элемента.
4. Повторяют опыт с другими приготовленными растворами. Полученные данные заносят в таблицу.
5. Заменяют стеклянный электрод на платиновый или золотоуглеродистый и повторяют всю серию опытов (согласно пп. 1—4) с той лишь разницей, что в каждый раствор добавляют небольшое количество хингидрона. (Время установления равновесия после добавления хингидрона составляет примерно 2-3 минуты.)
6. Проводят расчет значений рН растворов, полученных двумя способами, и сравнивают результаты расчетов между собой.
Рекомендуемый вид таблицы
| Раствор | Стеклянный эл-д | Хингидонный эл-д | Сходимость, % | ||
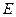 , В , В
| рН | 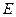 , В , В
| рН | ||
| Буфер | |||||
| № 1 | |||||
| № 2 | |||||
| № 3 |
Работа № 3.
Определение среднего коэффициента активности
электролита методом потенциометрии
Цель
Определить значения среднего коэффициента активности растворов соляной кислоты методом потенциометрии.
Задачи
1. Измерить ЭДС гальванического элемента, составленного из стеклянного и хлоридсеребряного электродов, с растворами соляной кислоты различной концентрации;
2. Способом графической экстраполяции определить значение стандартной ЭДС, используемого гальванического элемента;
3. Рассчитать значения среднего коэффициента активности растворов соляной кислоты различной концентрации.
Приборы и реактивы
1. Учебно-лабораторный комплекс "Химия" в следующей комплектации:
— центральный контроллер;
— модуль «Электрохимия» в комплекте со стаканчиком (50 см3), датчиком температуры, стеклянным и серебряным электродами и шнурами для подсоединения электродов;
2. Раствор соляной кислоты с известной концентрацией (0.1 М), дистиллированная вода, раствор AgN03 (примерно 0.01 М);
3. Две пипетки на 10 см3, лабораторная посуда.
Методика выполнения работы и ее обоснование
Для определения среднего коэффициента активности электролита необходимо составить элемент, состоящий из электродов обратимых относительно катиона и аниона исследуемого электролита. Кроме того, чтобы исключить возникновение диффузионного потенциала, элемент не должен содержать жидкостной границы. Для определения среднего коэффициента активности раствора соляной кислоты можно использовать гальванический элемент, состоящий из хлоридсеребряного и стеклянного электродов
Ag | AgCl | HCl(aq) | стекло | HC1(0.1 M) | AgCl | Ag.
ЭДС этого гальванического элемента будет
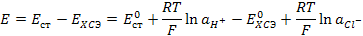 . (3.39)
. (3.39)
Учитывая, что 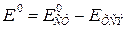 , получим
, получим
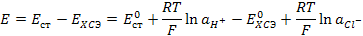 . (3.40)
. (3.40)
После небольших преобразований
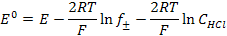 . (3.41)
. (3.41)
Для предельно разбавленного раствора
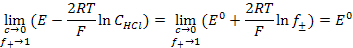 . (3.42)
. (3.42)
Обозначим 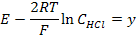 .
.
Согласно теории Дебая-Хюккеля для разбавленных растворов должна наблюдаться прямолинейная зависимость в координатах 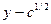 . Таким образом, экстраполируя зависимость до нулевой концентрации, мы можем определить значение стандартной ЭДС используемого гальванического элемента.
. Таким образом, экстраполируя зависимость до нулевой концентрации, мы можем определить значение стандартной ЭДС используемого гальванического элемента.
Зная значение 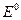 можно рассчитать средний коэффициент активности раствора соляной кислоты используя уравнение (3.41).
можно рассчитать средний коэффициент активности раствора соляной кислоты используя уравнение (3.41).
Порядок выполнения работы
1. Перед проведением первого опыта поверхность серебряного электрода осторожно, но тщательно очищают лезвием от оксидов или сульфидов серебра, которые могли образоваться при хранении электродов. Вместо механической очистки можно обработать электрод концентрированным раствором аммиака (несколько минут).
2. Тщательно вымытый стаканчик на 50 см3 устанавливают в штатив модуля и помещают в него с помощью пипетки 20 см3 раствора соляной кислоты. В стаканчик вносят несколько капель раствора нитрата серебра для создания раствора насыщенного относительно ионов серебра (I) (это необходимо для получения хлоридсеребряного электрода, обратимого относительно хлорид-ионов). Далее в стаканчике устанавливают: серебряный и стеклянный электроды и один термодатчик.
3. Подключение электродов и термодатчика производят согласно схеме.
4. После установления равновесия (3-5 минут) производят измерение ЭДС гальванического элемента и заносят полученное значение в таблицу.
5. Производят разбавление раствора соляной кислоты в два раза. Для этого, отбирают пипеткой 10 см3 раствора и помещают вместо него 10 см3 дистиллированной воды (целесообразно использовать две пипетки — одну для раствора, другую для воды). После установления равновесия (3-5 минут) производят измерение ЭДС гальванического элемента и заносят полученное значение в таблицу.
6. Повторяют разбавление с последующим измерением ЭДС 2-3 раза.
7. Далее строят график в координатах 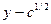 и экстраполируя зависимость до нулевой концентрации определяем значение
и экстраполируя зависимость до нулевой концентрации определяем значение 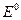 .
.
8. Вычисляют значения  и
и 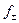 по уравнению (3.41) для различных концентраций раствора НС1 и данные заносят в таблицу.
по уравнению (3.41) для различных концентраций раствора НС1 и данные заносят в таблицу.
Рекомендуемый вид таблицы
| СHCl, M | 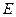 ,B ,B
| y | C1/2 | 
| 
|
Справочные данные (для сравнения):
для НС1 (0.1 M) 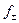 =0,796;
=0,796;
для НС1 (0.05 M) 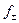 =0,830
=0,830
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 2076; Нарушение авторских прав?; Мы поможем в написании вашей работы!