
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа и степень диссоциации слабого электролита
|
|
|
|
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Кравновесию, которое устанавливается в растворе слабого электролита
между ионами и молекулами можно применить законы химического
равновесия и записать выражение константы равновесия. Например, для
диссоциации типичного слабого электролита — уксусной кислоты
CH3COOH 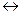 H+ + CH3COO-
H+ + CH3COO-
константа равновесия КС, выраженная через молярные концентрации реагентов (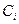 ), имеет вид:
), имеет вид:
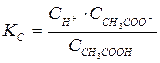 . (4.1)
. (4.1)
Константа равновесия диссоциации слабого электролита называется
константой диссоциации (К). Величина К зависит от природы электролита и
растворителя, а также от температуры. Термодинамическая константа
диссоциации, выраженная через активность ионов и молекул, не зависит от
концентрации. Вычисленная практическая константа диссоциации (К) может
изменяться с изменением концентрации. Поэтому для сравнения значения практической константы диссоциации
со справочным при заданной температуре, рассчитанные для разных
концентраций, усредняются.
Константа диссоциации характеризует способность данного электролита
распадаться на ионы в растворе. Чем больше К, тем полнее диссоциирует
электролит в растворе.
Получим в наиболее общем виде выражение для константы диссоциации
слабого электролита ( ) через его начальную концентрацию (С) и
) через его начальную концентрацию (С) и
степень диссоциации (α), исходя из следующей схемы диссоциации,
соответствующей суммарному равновесию:
 . (4.2)
. (4.2)
Константа диссоциации этого суммарного процесса равна:
 , (4.3)
, (4.3)
где  — равновесные активности компонентов. Выразим их через соответствующие коэффициенты активности (
— равновесные активности компонентов. Выразим их через соответствующие коэффициенты активности ( ):
):
 ;
; 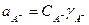 ;
; 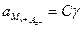 . (4.4)
. (4.4)
Для разбавленных растворов  ,
, 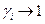 , тогда
, тогда  , где
, где 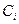 — равновесные концентрации компонентов. В этом случае для начальной молярной концентрации электролита С м (моль/л) равновесные концентрации компонентов с учетом степени диссоциации будут равны:
— равновесные концентрации компонентов. В этом случае для начальной молярной концентрации электролита С м (моль/л) равновесные концентрации компонентов с учетом степени диссоциации будут равны:
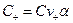 ;
; 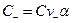 ;
; 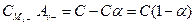 . (4.5)
. (4.5)
С учетом вышеизложенного из (4.3) получим:
 . (4.6)
. (4.6)
Приведем примеры.
CH3COOH 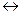 H+ + CH3COO-
H+ + CH3COO-
 ;
; 
 . (4.7)
. (4.7)
Это уравнение для константы диссоциации выражает закон разведения Оствальда.
Слабые электролиты, для которых ν > 2, в меньшей степени отвечают
условию (4.4) вследствие возрастания сил ионного взаимодействия, кроме того,
в этих случаях процесс диссоциации может протекать в несколько стадий,
каждая из которых имеет свое значение К.
Например, угольная кислота диссоциирует в две ступени:

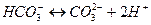 .
.
Константа диссоциации (равновесия)
по 1-ой ступени –  ,
,
по 2-ой ступени – 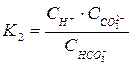 .
.
Суммарному равновесию соответствует константа -
диссоциации:

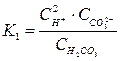 .
.
При этом выполняется соотношение  и, как правило,
и, как правило,  .
.
Из уравнения (4.5) константа диссоциации для этого типа электролитов рассчитывается по уравнению:
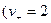 ;
; 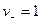 ;
; 
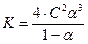 . (4.8)
. (4.8)
Расчет константы диссоциации электролитов, для которых ν > 3, из
кондуктометрических измерений, по причинам, изложенным выше, приведет
к значительным ошибкам, поэтому проводить его в этом случае, на наш взгляд,
нецелесообразно.
Решая уравнение (4.7) относительно α, получим:
 . (4.9)
. (4.9)
Уравнение (4.8) позволяет рассчитывать степень диссоциации (α) по
известному значению константы диссоциации слабого электролита для
различных концентраций. Для малых значений α, когда 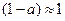 , уравнение (4.7) принимает вид
, уравнение (4.7) принимает вид
 , или
, или  . (4.10)
. (4.10)
То есть степень диссоциации уменьшается при возрастании концентрации
раствора слабого электролита. Объясняется это тем, что разбавление раствора
не препятствует прямому процессу в равновесии (распаду молекул), но
затрудняет обратный процесс образования молекул из ионов при их
столкновении. Значения констант диссоциации электролитов приводятся в
справочниках. Например, для уксусной кислоты при 298 К 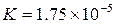 .
.
Для процесса диссоциации воды
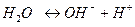
 . (4.11)
. (4.11)
Концентрация воды (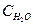 ) в водных растворах остается практически постоянной, так как вода диссоциирует на ионы очень слабо.
) в водных растворах остается практически постоянной, так как вода диссоциирует на ионы очень слабо.
Из (4.11) получаем
 . (4.12)
. (4.12)
Величину КWназывают ионным произведением воды. В чистой воде при 25 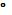 C
C 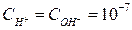 моль/л, поэтому
моль/л, поэтому  .
.
При увеличении температуры  заметно растет и при 100
заметно растет и при 100 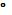 С достигает
С достигает  =
= 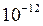 .
.
Температурная зависимость константы диссоциации выражается уравнением изобары реакции:
Эти уравнения выражают зависимость константы равновесия реакции от температуры и в дифференциальном виде имеют вид:
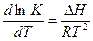 . (4.13)
. (4.13)
Если тепловой эффект реакции положителен  , то
, то  .
.
Это означает, что с ростом температуры константа равновесия
эндотермической реакции всегда увеличивается, следовательно, увеличивается α — степень диссоциации электролитов. Если  , то
, то  . В этом
. В этом
случае с ростом температуры константа диссоциации уменьшается,
следовательно, уменьшается и α.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1295; Нарушение авторских прав?; Мы поможем в написании вашей работы!