
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Работа №1 Газовые законы. Тарировка газового термометра
|
|
|
|
Методические указания
ФИЗИКА
Термодинамика, теплопередача, тепло и массообмен
к лабораторным работам
для студентов очной, заочной и дистанционной формы обучения
Автор доц. Фицак В.В.
САНКТ-ПЕТЕРБУРГ
2009 г.
Содержание
Работа №1 Газовые законы. Тарировка газового термометра. 3
Работа №2 Цикл тепловой машины.. 8
Работа № 6 Определение теплоемкости твердого тела. 12
Работа № 8 Определение показателя адиабаты при адиабатическом расширении газа. 15
Работа № 10 Определение коэффициента термического расширения (линейного) твердого тела 18
Работа № 11 Определение коэффициента термического расширения (объемного) жидкости 22
Работа № 12 Исследование эффекта Джоуля-Томпсона при адиабатическом истечении газа 25
Работа № 13 Исследование диффузии газов. 29
Работа № 17 Определение теплопроводности газов методом нагретой нити. 35
Работа № 18 Определение теплопроводности твердого тела (пластина) 39
Цель работы:
1) экспериментальная проверка уравнений состояния идеального газа;
2) демонстрация принципа работы газового термометра.
Идеальным называется газ, в котором отсутствуют силы межмолекулярного взаимодействия и возможно пренебрежение размерами молекул газа. Реальные газы с достаточной степенью точности можно считать тогда, когда они находятся в состояниях, далеких от областей фазовых превращений.
Состояние идеального газа характеризуется переменными  ,
, 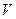 и
и  , называемыми параметрами состояния. Процессы в газе также характеризуются величинами
, называемыми параметрами состояния. Процессы в газе также характеризуются величинами  и
и  , определяющими энергетические процессы в системе газ-окружающая среда.
, определяющими энергетические процессы в системе газ-окружающая среда.
В общем случае состояние идеального газа описывается уравнением Менделеева‑Клапейрона:
 [1]
[1]
где:  - давление газа, Па;
- давление газа, Па;
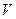 - объем, занимаемый газом, м3;
- объем, занимаемый газом, м3;
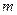 - масса газа, кг;
- масса газа, кг;
 - молярная масса газа, кг/моль;
- молярная масса газа, кг/моль;
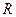 - газовая постоянная, равная 8,31 Дж/моль×град;
- газовая постоянная, равная 8,31 Дж/моль×град;
 - температура, град. К.
- температура, град. К.
В частных случаях вместо уравнения Менделеева-Клапейрона можно использовать законы:
а) Закон Бойля-Мариотта (изотермический процесс): при неизменных температуре и массе произведение численных значений давления и объема газа постоянно:
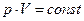 [2]
[2]
б) Закон Гей-Люссака (изобарный процесс): при постоянном давлении объем данной массы газа прямо пропорционален его абсолютной температуре:
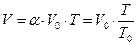 [3]
[3]
где 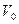 - объем газа при температуре
- объем газа при температуре 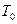 =273,15°К,
=273,15°К,
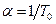 - коэффициент объемного расширения.
- коэффициент объемного расширения.
в) Закон Шарля (изохорный процесс): при постоянном объеме давление данной массы газа прямо пропорционально его абсолютной температуре:
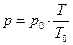 [4]
[4]
где 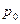 - давление газа при температуре
- давление газа при температуре 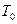 =273,15°К.
=273,15°К.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1013; Нарушение авторских прав?; Мы поможем в написании вашей работы!