
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энтропии в изопроцессах
|
|
|
|
По первому закону термодинамики: dQ = dU + dА. Известно, что для обратимых процессов: 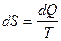 , поэтому dQ=T dS.
, поэтому dQ=T dS.
Применим эти формулы к идеальному газу: T dS = dU + dА
или 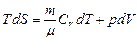 .
.
Используя уравнения Менделеева-Клапейрона: 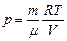 , получим
, получим
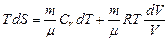 .
.
Произведя разделение переменных, получим 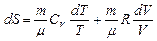 .
.
Изменение энтропии при термодинамических процессах в идеальном газе:
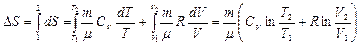 . (8.11.1)
. (8.11.1)
Уравнение Менделеева-Клапейрона позволяет выразить изменение энтропии через другие параметры состояния идеального газа:
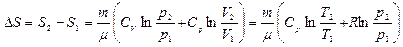 . (8.11.2)
. (8.11.2)
При переходе идеального газа из состояния 1 в состояние 2 изменение энтропии не зависит от типа процесса перехода.
а) Обратимся к изотермическому процессу (Т1=Т2) 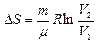 .
.
Первый закон термодинамики:
T dS = dU + dА
dА =T dS - dU=– d(U – T S)= – dF (8.11.3)
F= U – T S – третья функция состояния, которая называется свободной энергией.
Свободная энергия – это та часть энергии, которая при обратимом изотермическом процессе может быть полностью обращена в тепло (в работу, так dQ=dA).
б) Для адиабатного процесса: dQ=0, следовательно 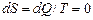 , то есть при адиабатных процессах энтропия не изменяет своего значения. Поэтому обратимый адиабатный процесс называют также изэнтропическим, а адиабату изэнтропией.
, то есть при адиабатных процессах энтропия не изменяет своего значения. Поэтому обратимый адиабатный процесс называют также изэнтропическим, а адиабату изэнтропией.
в) При изохорном процессе (V1=V2)
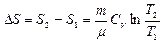
г) При изобарном процессе:
dQ = dU + pdV
dQ = d(U + pV)=dH, → T dS = dH
H= U + pV – четвертая функция состояния – энтальпия.
Изменение энтальпии равно количеству теплоты, которое сообщают системе или отводят от нее при постоянном давлении. DН характеризует тепловые эффекты фазовых переходов, химических реакций и других процессов при постоянном давлении.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 522; Нарушение авторских прав?; Мы поможем в написании вашей работы!