
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
IX РОЗВ’ЯЗАННЯ
|
|
|
|
ТИПОВІ НАВЧАЛЬНІ ЗАДАЧІ ТА ПРИКЛАДИ
Інтернет ресурси
Методичні матеріали
1. Органічна хімія. Опорні конспекти лекцій. Навчальне видання. / Е.Ф. Кравченко, Н.В. Мурликіна. – Харків: ХДАТОХ, 2002. – 128 с.
2. Кравченко Е.Ф. Вуглеводи. Методичні вказівки до самостійної роботи. Харків: ХДАТОХ, 2000. – 50 с.
3. Фетисова М.М. Методичні вказівки з самостійного вивчення теми «Правило заміщення у бензеновому ядрі». ХДАТОХ, Харків, 2002. – 10 с.
4. Органічна хімія. Вуглеводні й оксигеновмісні похідні. Лабораторний практикум. Навчальне видання. / Н.В. Мурликіна, О.І. Упатова, О.Г. Уклеїна – Харків: ХДУХТ, 2009. – 96 с.
5. Хімічні основи харчових технологій. Органічна хімія. Гетерофункціональні похідні та гетероциклічні сполуки Лабораторний практикум. Навчальне видання. / Н.В. Мурликіна, О.І. Упатова, О.Г. Уклеїна – Харків: ХДУХТ, 2010. – 110 с.
1. http://www.wpi.edu/Academics/Depts/Chemistry/Courses/General/
2.http://www.wpi.edu/Academics/Depts/Chemistry/Courses/General/kinfephtim.html
3. http://wps.pearsoned.co.uk/ema_uk_he_housecroft_inorgchem_2/
4. http://www.usd.edu/~gsereda/computer.html
5. http://www.jce.divched.org/CERS/
6. http://www.uni-regensburg.de/Fakultaeten/nat_Fak_IV/Organische _Chemie/Didaktik/Keusch/link.htm
7.http://www.rsc.org/Membership/Networking/InterestGroups/EducationalTechniques/ChemistryCassettes/index.asp
Усі запитання в кожному розділі пропонованих контрольних робіт можна поділити на п’ять основних типів:
1. Ізомерія та номенклатура органічних сполук;
2. Синтез за допомогою вихідних речовин;
3. Синтез на основі формули будови заданої речовини;
4. Синтез заданої сполуки із зазначеної речовини (іноді зазначається шлях синтезу);
5. Синтез речовини та написання для неї низки хімічних реакцій.
Тема Насичені вуглеводні. Алкани
Навчальна задача №1
Написати напівструктурну формулу сполуки 2,3-диметил-3-ізо-пропілгексан. Скласти схему реакції її з хлором (1 моль, за умов опромінення світлом).
Розв’язання
Загальний підхід. З назви слід визначити головний ланцюг атомів Карбону зазначеного вуглеводню. Потім записати формулу вуглеводню і позначити порядкові номери атомів Карбону у головному ланцюгу. Визначити в назві замісники і їх місцеположення в головному ланцюгу; розмістити їх біля відповідних атомів Карбону. Формули і назви радикалів ― замісників наведено в таблиці 2 додатку [С. 43–44]. Після цього залишається біля атомів Карбону головного ланцюга дописати атоми Гідрогену, враховуючи, що валентність атому Карбону в органічних сполуках дорівнює чотирьом.
1 етап. Із назви вуглеводню видно, що головний ланцюг у нього ― гексан. Біля другого і третього атомів Карбону розміщено замісники ― радикали метил; біля третього атому ― радикал ізопропіл:

|
Після заповнення вільних валентностей атомами Гідрогену формула матиме наступний вигляд:
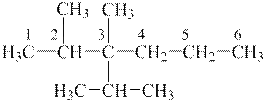
|
2 етап. Складаючи схему реакції цього вуглеводню з хлором, необхідно пам’ятати, що для алканів характерними є реакції заміщення, причому, якщо у реакції бере участь розгалужена молекула, то заміщення Гідрогену легше відбуватиметься за третинного атому Карбону ― за даного випадку це атом Карбону №2.
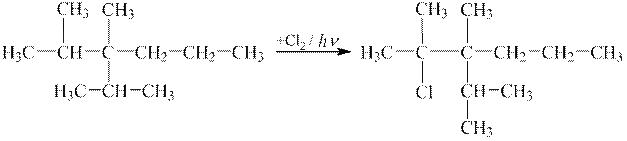
| |
| 2,3-диметил-3-ізопропілгексан | 2-хлор-2,3-диметил-3-ізопропілгексан |
Навчальна задача №2
Одержати двома способами (відновленням відповідного алкену та з галогенопохідних за реакцією Вюрца) 2,4-диметилпентан.
Розв’язання
Загальний підхід. Для синтезу речовини, виходячи з її формули, необхідно:
1. Записати формулу одержуваної речовини;
2. Скласти і написати формулу вихідної речовини;
3. Продумати шлях синтезу, написати схему реакції.
1 етап. Виходячи з назви, складаємо формулу речовини, яку слід одержати:
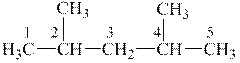
|
| 2,4-диметилпентан |
Це алкан. За умовою перший спосіб одержання ― з відповідного алкену. Добираємо алкен з таким же карбоновим скелетом: подвійний зв’язок може знаходитись між будь-яких двох атомів Карбону, наприклад:

|
Алкен перетворюється на алкан за умов каталітичного гідрування:

| |
| 2,4-диметил-2-пентен | 2,4-диметилпентан |
2 етап. Синтез алканів з галогенпохідних з меншою кількістю атомів Карбону, ніж у сполуці, яку слід одержати, проводять у присутності металічного натрію (синтез Вюрца). Для розв’язання задачі необхідно розділити формулу на дві будь-які частини-фрагменти, що і повинні входити до формули вихідних галогенпохідних.
Формула сполуки, яку необхідно одержати:
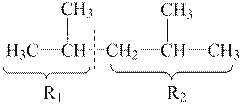
|
Галогенпохідні вибраних фрагментів уводимо в реакцію:
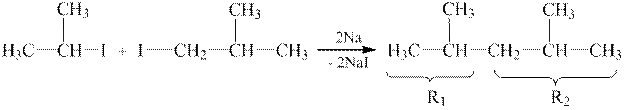
| ||
| 2-йодпропан | 1-йоD-2-метилпропан | 2,4-диметилпентан |
Але слід пам’ятати, що з суміші двох різних галогенпохідних за реакцією Вюрца завжди утворюється ще дві побічних сполуки:
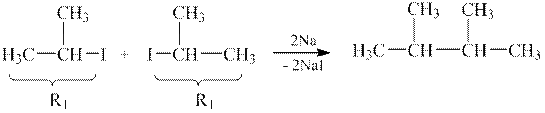
| |
| 2,3-диметилбутан |

| |
| 2,5-диметилгексан |
Суміш алканів, які утворюються в реакції Вірца, можна розділити за допомогою перегонки.
Тема Ненасичені вуглеводні
Навчальна задача №1
Одержати ненасичений вуглеводень дегідратацією 2-метил-3-гексанолу і на продукт реакції подіяти гідрогенбромідом. Відповідь підтвердити схемами відповідних реакцій.
Загальний підхід. Виходячи з того, що у назві вихідної сполуки присутній суфікс «ол», то 2-метил-3-гексанол є спиртом. Дегідратація спиртів (відщеплення молекули води) відбувається у присутності водовідщеплюючих засобів за умов нагрівання. Дегідратація може бути проведена внутрішньомолекулярно (у такому випадку утворюється алкен) або ― міжмолекулярно (у такому випадку утворюється етер), результат залежить від умов проведення реакції.
1 етап. За правилом А. М. Зайцева за внутрішньомолекулярної дегідратації Гідроген відщеплюється від найменш гідрогенізованого з сусідніх з гідроксилом атомів Карбону:
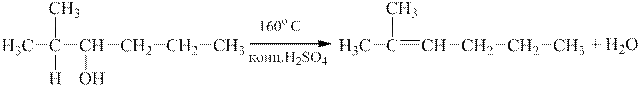
| |
| 2-метил-3-гексанол (спирт) | 2-метил-3-гексен (алкен) |
2 етап. Для 2-метил-2-гексену, як для алкену, характерні реакції приєднання за місцем розриву π -зв’язку. Зображуючи схему реакції приєднання, необхідно пам’ятати правило Марковникова: за місцем розриву π -зв’язку Гідроген приєднується до найбільш гідрогенізованого, а галоген ― до менш гідрогенізованого атому Карбону.

| ||
| 2-метил-3-гексен (алкен) | 2-бром-2-метилгексан | |
Навчальна задача №2
Написати чотири ізомери складу С6Н10, які можна віднести до алкадієнів зі спряженими зв’язками. Для одного з ізомерів написати схеми наступних реакцій:
а) з бромною водою;
б) полімеризації.
Загальний підхід. Загальна формула C n H2 n -2 (до якої можна віднести СбНІ0) відповідає гомологічним рядам алкінів і алкадієнів. Алкадієни поділяють на три типи: з кумульованими, ізольованими і спряженими зв’язками. У дієнів зі спряженими зв’язками два подвійні зв’язки розділені одним ординарним зв’язком. У такій системі два ненасичених центри діють як єдине ціле. У зв’язку з цим типові для ненасичених вуглеводнів реакції приєднання відбуваються за двома напрямками: або в положенні 1,4 (за крайніми положеннями системи спряжених зв’язків; між 2 і 3 атомами Карбону утворюється новий подвійний зв’язок), або ― 1,2-приєднання (традиційно за місцем розриву одного з подвійних зв’язків). Кінцевий результат (приєднання в положенні 1,4 чи в положенні 1,2) залежить від природи реагуючих речовин і умов проведення реакції, але найбільш ймовірним є приєднання в положенні 1,4.
1 етап. Ізомерія ненасичених вуглеводнів зумовлена ізомерією карбонового ланцюгу та ізомерією положення подвійних зв’язків. Виходячи із формули ізомерів, необхідно спочатку будувати схеми карбонових ланцюгів, поступово скорочуючи головний ланцюг, і розташовувати атоми Карбону, що залишилися, у вигляді розгалужених (бічних ланцюгів) в усіх можливих положеннях. Кожний карбоновий ланцюг, що утворюється, може існувати у вигляді декількох ізомерів з різним розміщенням подвійних зв’язків.
У лінійному ланцюгу з шести атомів Карбону спряжені зв’язки можливо розмістити двома способами:

| і | 
|
Для третього і четвертого ізомерів одержуємо новий карбоновий ланцюг:

| 
|
Повні формули отримуємо після заповнення усіх зв’язків атомів Карбону карбонових скелетів атомами Гідрогену:
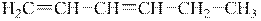
| 
|
| 1,3-гексадієн | 2,4-гексадієн |
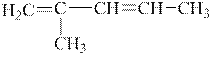
| 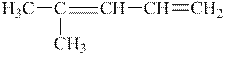
|
| 2-метил-1,3-пентадієн | 2-метил-2,4-пентадієн |
2 етап. Виходячи з того, що для спряжених дієнів більш характерним є 1,4-приєднання, однак, можливим є і 1,2-приєднання, запишемо схему реакції:

|
3 етап. Характерною особливістю дієнів зі спряженими зв’язками є їх здатність до полімеризації. Процес полімеризації відбувається за дії каталізаторів, під впливом світла і навіть самочинно. Макромолекула утворюється за рахунок сполучення молекул мономерів у положенні 1,4:
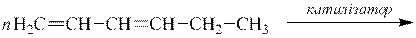
|
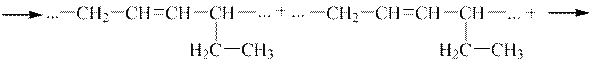
|
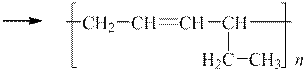
|
| Полімер 1,3-гексадієну |
Тема Ароматичні вуглеводні
Навчальна задача
Написати схеми наступних перетворень:
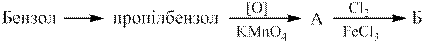
|
Загальний підхід. Для синтезу сполуки, виходячи з її формули, слід вибрати вихідні сполуки, розбивши формулу необхідної сполуки на фрагменти:

|
1 етап. Таким чином, у молекулу бензолу необхідно ввести алкільний радикал ― пропіл. Один із методів одержання гомологів бензолу ― синтез Фріделя-Крафтса. Алькільний радикал вводять у кільце за дії на бензол галоїдалкілів за присутності алюміній хлориду.
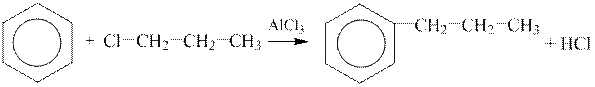
| ||
| бензол | 1-хлорпропан | пропілбензол |
2 етап. Бензольне кільце є стійким до дії окисників. Окисненню піддаються бічні відгалуження, причому ланцюги будь-якого складу руйнуються і «згоряють», а в кільці залишається, як замісник, тільки один атом Карбону, який окиснюється до карбоксильної групи. Утворюється ароматична кислота:
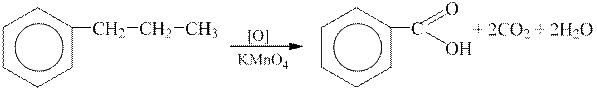
| |
| бензойна кислота |
3 етап. За умовою задачі на продукт окиснення необхідно подіяти хлором у присутності ферум(ІІІ) хлориду. Це реакція електрофільного заміщення. У похідних бензолу (за типом С6Н5- х ), які мають замісник, атоми Карбону в кільці нерівноцінні за електронною густиною, тому за уведення іншого замісника можливим стає утворення трьох ізомерів. Місце, куди буде спрямовуватися другий електрофільний замісник, визначатиметься природою замісника, який уже знаходиться в кільці (тобто першого або орієнтуючого замісника). Орієнтуючі замісники в бензольному кільці поділяють на дві групи: орто -– пара - і мета -орієнтанти. Карбоксильна група ― це орієнтант ІІ роду, тому наступний замісник буде направлятися в мета -положення відносно карбоксильної групи:

| |
| бензойна кислота | мета -хлорбензойна кислота |
Тема Спирти, етери
Навчальна задача №1
Одержати 2-пропанол із відповідного кетону. На 2-пропанол подіяти оцтовою кислотою у присутності концентрованої сульфатної кислоти. Написати схеми відповідних реакцій і назвати одержані сполуки.
Загальний підхід. Виходячи з назви сполуки, що має суфікс «ол», слід одержати спирт наступної будови:

|
| 2-пропанол |
Це вторинний спирт, оскільки гідроксильна група знаходиться біля вторинного атому Карбону. Кетон, який відповідатиме спирту з тим же числом атомів Карбону, повинен мати такий же карбоновий скелет, а карбонільна група повинна знаходитись біля другого атому Карбону (тобто там же, де гідроксил у спирті):
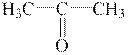
|
| 2-пропанон |
1 етап. Вторинний спнрт і кетон генетично зв’язані один з одним взаємними окисно-відновними перетвореннями:
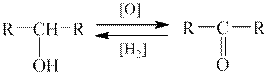
| ||
| Вторинний спирт | Кетон |
Таким чином, для одержання 2-пропанолу проводимо каталітичне відновлення 2-пропанону:
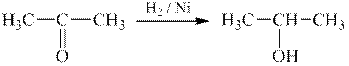
| ||
| пропанон | 2-пропанол |
2 етап. Спирти реагують з карбоновими кислотами з виділенням води і утворенням відповідних естерів. Ця реакція називається естерифікацією. Одержані естери під дією води, що виділяється, здатні піддаватися гідролізу:

| |||
| Кислота | Спирт | Естер | Вода |
Для зміщення рівноваги у бік утворення естеру (праворуч) слід зв’язати воду, що утворюється, концентрованою сульфатною кислотою:

| ||
| Оцтова кислота | Ізопропанол | Ізопропілацетат |
Тема Карбонові кислоти
Навчальна задача №1
З 1-хлорпропану одержати масляну кислоту, використовуючи ніт-рильний синтез. Написати схеми реакцій цієї кислоти з кальцій гідрокарбонатом і фосфор(V) хлоридом.
Загальний підхід. Порівнюючи формули вихідної сполуки і сполуки, що слід одержати, видно, що друга речовина має число атомів Карбону на один атом Карбону більше,ніж перша:

| 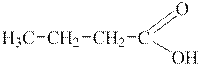
|
| 1-хлорпропан | Масляна (бутанова) кислота |
Збільшити карбоновий ланцюг на один атом Карбону можливо за рахунок нітрильного синтезу. Під дією солей синильної кислоти на галогенпохідні вуглеводнів утворюються нітрили кислот, таким чином у молекулу вводять додатковий атом Карбону:

|
Нітрили кислот, як й інші похідні карбонових кислот, в умовах гідролізу перетворюються на кислоти:
1 етап. З 1-хлорпропану одержують нітрил кислоти, в якому є 4 атоми Карбону, тобто нітрил масляної (бутанової) кислоти:

| |
| 1-хлорпропан | Нітрил масляної (бутанової) кислоти |
Гідроліз нітрілів у присутності мінеральних кислот перебігає з утворенням карбонових кислот:

|
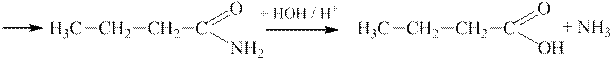
| |
| Амід масляної (бутанової) кислоти | Масляна (бутанова) кислота |
2 етап. У результаті реакцій взаємодії кислот з основами, солями, оксидами або активними металами Гідроген карбоксильної групи кислоти заміщується на метал і утворюються солі карбонових кислот:
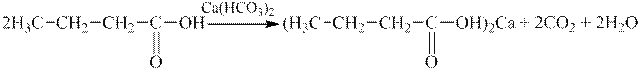
| |
| Масляна (бутанова) кислота | Кальцій бутират (бутаноат) |
3 етап. Гідроксил у карбоксильній групі може бути заміщений різними атомами або групою атомів. Сполуки, які при цьому утворюються, називають функціональними похідними карбонових кислот загальною формулою
 . .
|
У реакції взаємодії кислоти з фосфор(V) хлоридом гідроксигрупа заміщується на галоген (атом хлору) з утворенням галогенангідриду:

| |
| Масляна (бутанова) кислота | Хлорангідрид масляної (бутанової) кислоти ― бутирил (бутаноїл) хлорид |
Тема Вуглеводи
Навчальна задача
Написати схему взаємодії α -D-фруктофуранози з 1 моль етилового спирту (за присутності гідрогенхлориду).
Загальний підхід. α -D-фруктофураноза ― представник кетогексоз загальної формули C6H12O6. Наведена в умові назва D-фруктози свідчить, що вона представлена п’ятичленною (фуранозною) циклічною формою у вигляді α -таутомеру.
Приналежність до D-стереохімічного ряду показує, що конфігурація найбільш віддаленого від карбонільної групи асиметричного атому Карбону така, як і конфігурація D-гліцеринового альдегіду. Тому в проекційній структурній формулі гідроксигрупу розміщують праворуч.
І етап. Моносахариди у водних розчинах існують у п’яти таутомерних формах: в оксо- або карбонільній (нециклічній) і чотирьох циклічних напівацетальних формах (два п’ятичленних цикли ― фуранозні форми і два шестичленних ― піранозні форми).
Спочатку записують оксоформу D-фруктози, використовуючи проекційну формулу Фішера. Карбонільна група утворюється вторинним атомом Карбону, тому D-фруктоза є кетогексозою. Приналежність до D-ряду визначають за конфігурацією п’ятого атому Карбону.
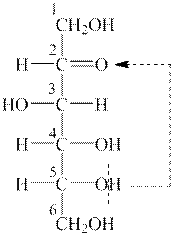
|
Утворення циклічних форм відбувається за рахунок таких перетворень: атом Гідрогену спиртової гідроксигрупи переходить до карбонільного Оксигену (за місцем розриву подвійного зв’язку), а Оксиген цього гідроксилу зв’язується з другим атомом Карбону. Якщо в перетвореннях бере участь гідроксил біля п’ятого атому Карбону, то утворюється п’ятичленний цикл, а якщо бере участь гідроксил біля шостого атому Карбону ― утворюється шестичленний цикл (тобто відбувається 1,5- або -1,4-взаємодія). Другий атом Карбону, який в оксоформі був карбонільним Карбоном, називають напівацетальним атомом Карбону, а зв’язана з ним гідроксигрупа ― напівацетальним або глікозидним гідроксилом. Цей атом Карбону в циклі стає асиметричним атомом і тому кожна напівацетальна форма, як піранозна, так і фуранозна, існують у вигляді двох стереоізомерів з протилежним просторовим розміщенням Гідрогену і гідроксигрупи біля напівацетального Карбону. Форми, в яких гідроксигрупа розміщується з того боку, з якого розташовується гідроксигрупа біля асиметричного атому Карбону, що визначає приналежність моносахариду до D-, L-ряду, відносяться до α -форм, а ті, у яких вона розміщується з протилежного боку, ― до β -форм.
Проекційні формули Фішера відображають будову моносахариду тільки умовно. Більш правильним і точним є спосіб відображення формул за Хеуорсом. Циклічні форми розмішують перспективно ― перпендикулярно до площини кільця, згори або знизу розміщують атоми Гідрогену і гідроксигрупи.
Таутомерну рівновагу, яка існує в розчині D-фруктози, використовуючи формули Хеуорса, відображують наступною схемою:
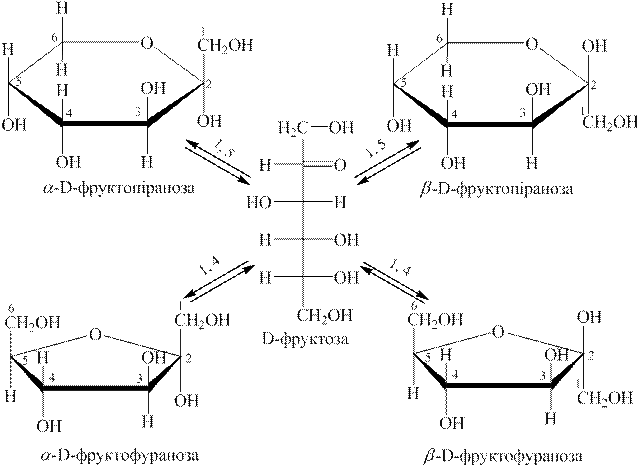
|
2 етап. Необхідно розрізняти, яка з існуючих у розчині таутомерних форм може вступати в ту або іншу реакцію. Якщо реакція відбувається за карбонільною групою, то реагуватиме розкрита оксоформа (яка має карбонільну групу). У реакціях утворення глікозидів беруть участь гідроксигрупи і, перш за все, найбільш активний напівацетальний гідроксил. Схеми таких реакцій необхідно писати, використовуючи одну з напівацетальних форм.
За умовою задачі реакцію слід проводити з α -D-фруктофуранозою. Реакція моносахаридів зі спиртами перебігає за напівацетальним гідроксилом з утворенням глікозиду ― похідного, в якому Гідроген гідроксигрупи заміщений на радикал. Реакція відбувається за умов нагрівання у присутності гідрогенхлориду. Інші гідроксогрупи за цих умов зі спиртами не взаємодіють.

| |
| α -D-фруктофураноза | Етил- α -D-фруктофуранозид |
Тема Аміни, амінокислоти, білки
Навчальна задача
Написати схему утворення трипептиду з галогенангідридів наступних амінокислот: цистеїну, аланіну і фенілаланіну. Яка кольорова реакція вказує на присутність у цьому пептиді ароматичного угруповання? Написати схему цієї реакції.
Загальний підхід. Різні амінокислоти під час одержання білків зв’язуються за рахунок карбоксильної й аміногрупи з утворенням угруповання –СО–NН–, яке називається пептидним зв’язком. Продукт взаємодії двох α -амінокислот називається дипептидом, трьох ― трипептидом, багатьох ― поліпептидом. Реакції утворення поліпептидів з α -амінокислот складають основу синтезу білкових сполук у живих організмах. Загальну формулу поліпептиду можна записати наступним чином:
 , де R ― різні угруповання атомів. , де R ― різні угруповання атомів.
|
1 етап. Для синтезу білкових сполук використовують галогенангідриди α-амінокислот. За умовою в реакцію вводимо хлорангідриди вказаних амінокислот:
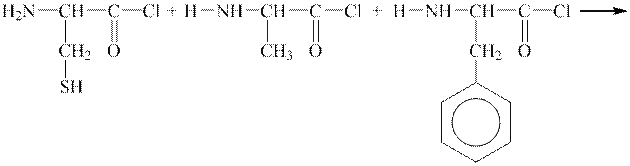
| ||
| хлорангідрид цистеїну | хлорангідрид аланіну | хлорангідрид фенілаланіну |
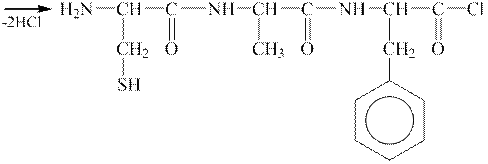
|
| трипептид: цистеїл-аланіл-фенілаланін |
Називають пептиди за назвами α -амінокислот, які входять до їх складу, замінюючи функціональне закінчення -ін на -іл у тривіальних назвах тих амінокислот, які прореагували карбоксильною групою і їх карбоксильні групи утворили пептидний зв’язок. Таким чином, одержаний трипептид називають цистеїл-аланіл-фенілаланін.
2 етап. Однією з якісних реакцій на білки є ксантопротеїнова реакція, яка доводить присутність у білках ароматичних α -амінокислот. За умов нагрівання такого білка з концентрованою нітратною (азотною) кислотою розчин і осад його забарвлюються на жовтий колір.
Ксантопротеїнова реакція ― це реакція нітрування ароматичного кільця. Схему реакції з фрагментом пептидного ланцюгу наведено нижче:
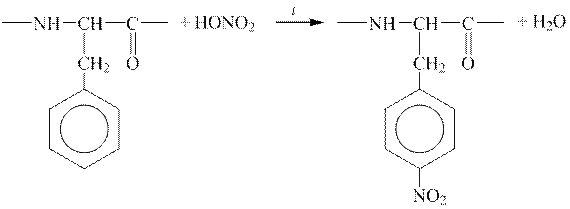
|
Тема Ліпіди
Навчальна задача
Написати схему вичерпної гідрогенізації простого тригліцериду, до складу якого входить олеїнова кислота. Навести схему одержання твердого мила.
Загальний підхід. Жири — це повні естери триатомного спирту гліцерину і вищих карбонових кислот, що мають загальну форму:
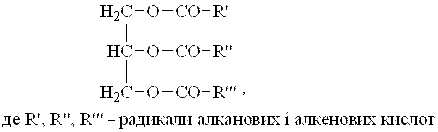
|
Три гідроксили гліцерину можуть бути естерифіковані або тільки однією кислотою, або двома, або трьома різними кислотами. Тригліцериди, молекули яких містять однакові залишки жирних кислот, називаються простими, якщо залишки різних кислот — змішаними. Природні жири і олії містять переважно змішані тригліцериди.
1 етап. Гідрогенізація олій і жирів воднем (Н2) здійснюється за температур 180…240 ºС у присутності нікелевих або мідно-нікелевих каталізаторів під тиском, як правило, близьким до атмосферного. Основна хімічна реакція, що перебігає під час гідрогенізації, — приєднання атомів Гідрогену до подвійних зв’язків залишків ненасичених жирних кислот:
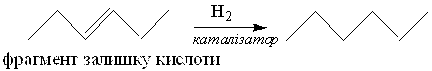
|
Схему гідрогенізації триолеїну можна зобразити наступним чином:

|
2 етап. В результаті взаємодії вищих карбонових кислот з водними розчинами лугів утворюються солі відповідних кислот, які називаються милами. Натрієві солі вищих жирних карбонових кислот являють собою тверде мило, калієві солі — рідке мило.
Схема одержання твердого мила:
С17Н35СООН + NaOH  С17Н35СООNa + H2O С17Н35СООNa + H2O
| ||
| Стеаринова кислота | Натрій стеарат |
Тема 9 Гетероциклічні сполуки
Навчальна задача
Написати схему одержання фурфуролу із пентоз. Навести схему реакції, за допомогою якої із фурфуролу можна одержати фуран.
Загальний підхід. Найпоширенішими п’ятичленними сполуками з одним гетероатомом є фуран, тіофен і пірол. Їх можна розглядати як продукти заміщення в бензольному ядрі фрагмента −СН=СН− гетероатомом з неподіленою парою електронів:

| 
| 
|
| Фуран | Тіофен | Пірол |
Серед похідних фурану найбільше значення має фурфурол ― a -фуриловий альдегід, який за властивостями подібний до ароматичних альдегідів. Він використовується для виробництва деяких бактерицидних лікарських препаратів (фурацилін, фурадонін тощо), як сировина для фенолальдегідних пластмас і синтетичних волокон, в органічному синтезі тощо.
Фурфурол — безбарвна рідина з температурою кипіння 102 °С і запахом житнього хліба, точніше, житній хліб має запах фурфуролу, який утворюється з пентоз під час випікання борошняних виробів.
1 етап. Фурфурол одержують нагріванням у кислому середовищі пентозовмісних полісахаридів — пентозанів (солома, висівки, соняшникове лушпиння, деревна тирса тощо). Процес починається з гідролізу пентозанів до альдопентоз (найчастіше до D-ксилози і D-арабінози), які далі дегідратуються на фурфурол:
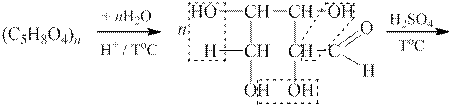
|
| Альдопентоза |

|
| Фурфурол |
2 етап. За хімічними властивостями фурфурол подібний до бензальдегіду і для нього характерними є реакції цього класу сполук. Так, він взаємодіє з натрій гідрогенсульфітом ΝaHЅO3, синильною кислотою НСΝ, відновлюється до фурфурилового спирту й окиснюється до пірослізевої кислоти, вступає в реакцію Канніццаро.
У промисловості з природних вуглеводів (альдопентоз) добувають спочатку фурфурол, нагріванням якого в присутності каталізатора одержують фуран:

| |
| Фурфурол | Фуран |
4 ВКАЗІВКИ ДО ВИБОРУ КОНТРОЛЬНИХ ЗАВДАНЬ,
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 2154; Нарушение авторских прав?; Мы поможем в написании вашей работы!