
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 5. По уравнению Ван-дер-Ваальса вычислить температуру, при которой объём 1 кмоль метана станет равным 2 м3 под давлением 2,0265×106 Па. T - ? Си
|
|
|
|
Пример 4.
По уравнению Ван-дер-Ваальса вычислить температуру, при которой объём 1 кмоль метана станет равным 2 м3 под давлением 2,0265×106 Па.
| T -? | Си | |
| п = 1кмоль V = 2 м3 P =2, 0265×106 Па а = 2,28×10-1 Дж×м3/моль в = 4,28×10-5 м3/моль | 1×103моль | Используем уравнение Ван-дер-Вальса (Р + а/Vm2)(Vm - в) = RT Вначале рассчитали молярный объём. Vm = V/п, необходимые константы а, в возьмём из приложения 1 |
Vm = 2/1×103 =2·103 м3/моль
Выражаем 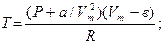
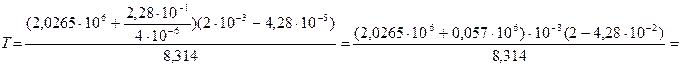
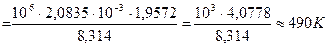
Определить парциальное давление этилбензола в смеси его с водяным паром на входе в реактор дегидрирования, если на 1 кг этилбензола (С8Н10) в смеси приходится 2,6 кг воды, температура смеси 605°С, давление 780 мм.рт.ст.
| Рэб -? | Си | Решение: |
| m(эб) = 1кг mв = 2,6 кг tсм = 605°С Рсм = 780мм. рт.ст M(в) = 18×10-3 кг/моль М(эб) = 106×10-3 кг/моль | 878 К 103991 Па | 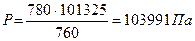 Задача на определение парциального давления из закона Дальтона.
Задача на определение парциального давления из закона Дальтона.
|
Решение:
1) Рi = xi Pсм;
Р(эб) = x(эб)× Pсм
2) Чтобы определить Р(эб) необходимо знать молярную долю этилбензола.
хi = пi/пcм; хэб = п(эб)/(пэб + пв)
3) Определяем количество этилбензола п эб и количество воды пв по формуле
п= m/M
пэб = mэб/Mэб ; пв = mв /Mв
пэб = 1/106×10 -3 =9,34 моль
пв = 2,6/18×10 -3 = 144 моль
x(эб) = 9,34/(9,34+144) = 6,09×10 –2
Р(эб) =6,09×10 -3× 103991 = 6,38×10 3 Па.
Пример 6.
Определить плотность синтез - газа нижеприведённого состава при 400°С и
Р = 3МПа (Мега Па).
СО – 31,0; Н2 – 51,5; СО2 – 15,0; СН4 = 1,0; N2 – 1,5; % (об.)
| r -? | Си | Плотность определяем по формуле
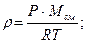 По правилу смешения находим среднюю молярную массу газовой смеси:
Мсм = х(СО)×М(СО) + х(Н2)×М(Н2) + М(СО2)×х(СО2) +
+ х(СН4)×М(СН4) + х(N2)×М(N2)
т.к. в газах jI = xi Þ V = п
x(CO) = п(CO)/пcм.
По правилу смешения находим среднюю молярную массу газовой смеси:
Мсм = х(СО)×М(СО) + х(Н2)×М(Н2) + М(СО2)×х(СО2) +
+ х(СН4)×М(СН4) + х(N2)×М(N2)
т.к. в газах jI = xi Þ V = п
x(CO) = п(CO)/пcм.
|
| φ(CO) = 31% φ (H2) =51,5% φ(CO2) = 15,0% φ(CH4) = 1,0% φ(N2) = 1,5% t = 400°C P = 3МПа R = 8,314 Дж/моль×К | 0,31 0,515 0,15 0,01 0,015 673К 3×106Па |
Решение:
Находим молярные массы веществ:
M(CO) = 28×10-3 кг/моль; М(H2) = 2×10-3 кг/моль; М(CO2) = 44×10-3 кг/моль;
М(СH4) = 16×10-3 кг/моль; М(N2) = 28×10-3 кг/моль.
М = (0,31×28+0,515×2+0,15×44+0,01×16+0,015×28)×10-3 = 16,89×10-3 (кг/моль)
r = 3 ×10-6×16,89×10-3/(8,314×673) = 9,06 кг/м3
Пример 7.
При какой температуре будет происходить кипение гексана в аппарате, давление которого 600 мм.рт.ст.
Решение:
По диаграмме (см. приложения) находим tк гексана. Она равна 61°С.
Пример 8.
Динамическая вязкость бензола при нормальной Тк равна 0,317Па×с, а плотность 815 кг/м3. Какова его кинематическая вязкость.
| n -? | n = h/r n = 0,317/815 = 3,89×10-4 (м2/с) = 3,89 Ст. |
| h = 0,317Па×с r = 815 кг/м3 |
Пример 9.
Определить какое количество теплоты расходуется для очистки методом перегонки 25 кг сероуглерода СS2, если tк = 46,3°С.
| Q -? | Cи | 1. Используем правило Троутона для определения молярной теплоты испарения. Qm = 89,12 × Тк Qm = 89,12×319,3 =28456 Дж/моль» 28,5 кДж/моль 2. Определяем теплоту испарения Q = n×Qm; n = m/M; n = 25/76×10–3»329 моль Q = 329×28,5 = 9376,5 кДж» 9,4 МДж |
| tк = 46,3°С m = 25 кг М (СS2) = 76×10–3 кг/моль | 319,3K |
Вопросы для самоконтроля:
1.Проанализируйте и исправьте обнаруженные ошибки:
а) при V = const давление газа обратно пропорционально температуре;
б) при смешении газов свойство смеси определяется как сумма свойств её компонентов.
2.Назовите основные свойства, отличающие реальный газ от идеального.
3.Почему жидкости практически несжимаемы?
4.Почему для поддержания кипения воды необходим постоянный подогрев?
5.В чём состоит основное различие связей в кристаллах ионного и атомного типа.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 4789; Нарушение авторских прав?; Мы поможем в написании вашей работы!