
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон термодинамики
|
|
|
|
Тема 1.2. Основы химической термодинамики.
Химическая термодинамика изучает связи между химической и другими видами энергии.
К основным понятиям относятся:
1. Система – это любой материальный объект, который изучает термодинамика. Все, что находится вне системы – окружающая среда. Виды систем:
· гомогенная система – физически однородная система. То есть в любой точке системы термодинамические свойства одинаковы (например, температура, плотность и т.д.);
· гетерогенная – физически неоднородная;
· изолированная система – это система, которая не обменивается с окружающей средой ни массой вещества, ни энергией;
· открытая – это система, которая обменивается с окружающей средой и массой вещества и энергией;
· закрытая – это система, которая обменивается с окружающей средой энергией, а массобмен отсутствует;
· адиабатно-изолированная – система, которая не принимает и не отдает тепло в окружающую среду.
2. Процесс – переход системы из одного состояния в другое при это параметры системы меняются (изотермический, изобарный, адиабатный; обратимый, необратимый; прямой, обратный, круговой; эндотермический, экзотермический).
3.Состояние системы – совокупность термодинамических свойств. Свойства делятся на экстенсивные (они выражают количественные характеристики термодинамической системы пр.: m, V) и интенсивные (выражают качественные характеристики системы пр.: T, P, состав).
4.Функции состояния системы (это любое свойство системы).
Изменение функций состояния системы не зависят от пути перехода, а зависят лишь от начального и конечного состояния системы: ∆Т = Т2-Т1;
Изменение функций состояния системы по круговому процессу равно нулю ∆ТКР =0
5.Функции процесса. К ним относятся работа и теплота. Это формы передачи энергии, т.е. энергообмен системы. Они зависят не только от начального и конечного состояния системы, но и от пути перехода
Работа – это перенос энергии движущейся материи (при перемещении тел в пространстве совершается механическая работа)
Работа [W] = Дж; кДж
W = РD V; W = F×l
Работа бывает положительной и отрицательной. Положительная рабо та – это работа, которую совершает система над окружающей средой. Отрицательная работа – это работа, которую совершает окружающая среда над системой.
Теплота – это внешнее проявление энергообмена частиц в результате их хаотического столкновения друг с другом.
Теплота [Q] = Дж; кДж
Q = СDT
Теплота бывает положительной и отрицательной. Положительная теплота – это теплота, поступающая из окружающей среды в систему. Отрицательная теплота – это теплота, поступающая от системы в окружающую среду.
С – теплоёмкость – способность веществ поглощать теплоту при нагревании
С = Q /DT –теплоёмкость системы, Дж/К.
Виды теплоёмкости:
1) удельная теплоёмкость с уд = Q/ mDT [суд] = Дж/(кг×К)
2) молярная теплоёмкость с m = Q/пDT [сm] = Дж/(моль×К)
3) объёмная теплоёмкость соб = Q/VDT [соб] = Дж/(м3·К)
Формулы взаимосвязи между этими теплоёмкостями:
С = п·сm; С =m·суд; С =V ·соб; соб = суд × r; сm = суд × M;
4) Изобарная теплоёмкость при Р = сonst Cp.
5) Изохорная теплоёмкость при V = const C v.
c р,m > cV,m Ср,m – CV,m = R – уравнение Майера
cp/cV = g (гамма) – коэффициент Пуассона или показатель адиабаты, служит для характеристики строения молекул.
6) Истинная теплоёмкость – теплоёмкость при заданной t°.
7) Средняя теплоёмкость С – теплоёмкость в интервале температур.
Теплоёмкость системы – аддитивное свойство, т.е С = С1 + С2 +… Ск
(к – число частей системы).
Теплоёмкость, состоящая из к компонентов определяется по правилу смешения
(следствие из закона Дальтона).
cm = cm,1 × x1 +cm,2 × x2 + …cm,k × xk.
Теплоёмкость зависит от t°, зависимость выражается формулами:
cр,m = a + bT + cT2 (*)
cp,m = a + bT + c'T –2 (**)
а, b, c, c ' – const (табличные значения)
После преобразований данных формул, расчёты средней теплоёмкости ведут по:
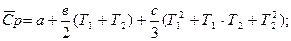 (*)
(*)
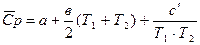 (**)
(**)
Когда в системе протекают лишь немеханические процессы (кроме изменения объёма системы V=const) в энергообмене участвует лишь её внутренняя энергия U.
Внутренняя энергия – это энергия изолированной системы
U = Ek + En + Em + Eя
Ek - кинетическая энергия;
En - потенциальная энергия;
Eх - энергия химических связей – взаимодействия внутримолекулярных частиц тела;
Eя – ядерная энергия – энергия взаимодействия внутриядерных частиц тела.
Свойства внутренней энергии обобщается в 1 законе термодинамики или законе сохранения энергии.
Он выражает количественную эквивалентность энергии.
Формулировки 1 закона термодинамики – закона сохранения энергии:
1. Энергия не возникает из ничего и не исчезает бесследно, а переходит из одной формы в другую в строго эквивалентных количествах.
2. В изолированной системе общий запас энергии постоянен.
3. Вечный двигатель 1 рода не возможен, т.к. невозможно создать такую машину, которая совершала бы работу без подведения энергии из окружающей среды
4. Теплота, поступающая в систему расходуется, на изменение внутренней энергии и на работу, которую система совершает над окружающей средой Q=DU+ W
Обобщенное математическое выражение 1 закона термодинамики:
D U = åQ - åW; å (знак суммы).
Изменение внутренней энергии равно теплотам, поступившим в систему за вычетом работ, совершённых системой над окружающей средой, с учётом расширения системы.
Система, окружённая упругой средой (упругой жидкостью, атмосферным воздухом, то есть это экстракционные, ректификационные, массообменные аппараты – открытые системы) дополнительно к внутренней энергией обладает потенциальным запасом энергии PV.
Полная энергия любой открытой системы называется энтальпией Н системы.
Н = U + PV; [H] = Дж
I закон термодинамики имеет следующий вид:
DН = åQ - åW'
åW ' – все немеханические работы (химическая, электрическая, адсорбции), исключая работу расширения системы.
Большинство аппаратов в химической технологии работают в режиме:
V, T = const (изохорно-изотермического процесса)
P, t = const (изобарно-изотермического процесса).
То при отсутствии работ поступающая теплота в систему численно равна теплоте, отводимой от системы.
åQприход = - åQрасход – формула теплового баланса.
Теплота, работа, внутренняя энергия, энтальпия относятся к термодинамическим функциям.
Рассмотрим эти функции в различных термодинамических процессах.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 1082; Нарушение авторских прав?; Мы поможем в написании вашей работы!