
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вещества органические и неорганические
|
|
|
|
Основные законы химии
Моль. Молярная масса
Типы химических реакций
1. Реакции разложения:
2КМnO4 = К2МnO4 + МnO2 + O2
2. Реакции соединения:
2Са + О2 = 2СаО
3. Реакции замещения:
2К + 2НСl = 2КСl + H2
4. Реакции обмена:
НСl + NaOH = NaCl + H2O
Количество вещества – это физико-химическая величина, которая показывает число структурных единиц (молекул, атомов, ионов и др.), образующих это вещество. Единицей количества вещества является моль. (γ)
Моль – это количество вещества, которое содержит столько структурных единиц, сколько атомов содержится в 12 г. вещества углерода. Один моль любого вещества содержит 6,02·1023 молекул или атомов. Это число называют числом Авогадро (Na).
Масса одного моля вещества называется молярной массой (М). Выражается молярная масса в кг/моль или г/моль. Молярная масса равна отношению массы вещества к его количеству: М = m\ γ
Молярная масса численно равна относительной молекулярной массе.
1. Закон сохранения массы (М.Ломоносов, 1748 г., А.Лавуазье, 1789 г.) – масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Закон сохранения массы не выполняется в ядерных реакциях.
Пример:
2Na + S = Na2 S
γ 2 моль 1 моль 1 моль
М 23 г/моль 32 г/моль 78 г/моль
m 46 г 32 г 78 г
46 + 32 = 78 г.
2. Периодический закон (Д.И.Менделеев, 1869 г.) – свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра элемента.
Периодическая таблица – графическое изображение периодического закона. Она состоит из семи периодов и восьми групп.
Современная периодическая система содержит 118 химических элементов, каждый из которых занимает определенное место (клетку) и имеет свой порядковый номер.
3. Закон постоянства состава (Ж.Пруст, 1808 г.) – все индивидуальные вещества имеют постоянный качественный и количественный состав, независимо от способа их получения.
Поэтому каждое вещество имеет свою химическую формулу. По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля элемента в данном веществе – это отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества.
W(X) = Аr (Х) · n/ Mr
Массовые доли выражаются в процентах или в долях единицы.
Пример: рассчитаем массовые доли водорода и кислорода в воде
W(Н) = Аr (Н) · 2/ Mr (Н2 О) = 1·2/18 = 0,11 или 11%
W(О) = Аr (О) · 1/ Mr (Н2 О) = 1·16/18 = 0,89 или 89%
4. Закон Авогадро (1811 г.) – в равных объемах газов при постоянных температуре и давлении содержится одинаковое число молекул. Объемы газов прямо пропорциональны их количествам:
γ1/ γ2 = V1/ V2
- Первоначальная классификация веществ
| Вещества | ||
| Минеральные | Растительные | Животные |
| Глинозем – Аl2 O3 Каменная соль – NaCl Кварц – SiO2 | Глюкоза – С6 Н12 О6 Щавелевая кислота СООН | СООН | Жиры |
Основоположником органической химии, т.е. химии, которая бы занималась изучением веществ, синтезируемых в растениях и животных был немецкий химик Берцелиус (1807 г.) Ошибкой Берцелиуса было утверждение о том, что органические вещества нельзя получить искусственным путем.
До 20-х годов 19 века это утверждение Берцелиуса о невозможности синтезировать органические вещества в лаборатории поддерживалось многими учеными. Предполагалось, что органические вещества образуются только в живой природе при участии особой «жизненной силы» Учение о жизненной силе называется «витализмом».
В 1824 г. ученик Берцелиуса – Велер синтезировал щавелевую кислоту
В 1828 г. Велер синтезирует мочевину- СО(NH2)2
В 1845 г. Кольбе синтезирует уксусную кислоту – СН3СООН
В 1851 г. Бертло синтезировал жиры
В 1861 г. Бутлеров синтезировал один из углеводов (сахаристые вещества)
2. Современная классификации веществ
| Вещества | |
| Неорганические | Органические |
| Разнообразного состава, нет такого химического элемента, который бы встречался во всех химических соединениях | Наряду с другими элементами всегда содержат углерод |
| Электролиты | Не электролиты |
| Твердые вещества с высокой температурой плавления | Жидкости или твердые вещества с низкой температурой плавления |
| Не окисляются на воздухе, не горючи | Окисляются на воздухе, горючи |
| Растворимы в воде | Нерастворимы ли плохо растворимы в воде |
Органическая химия – это химия соединений углерода.
Однако некоторые соединения углерода (оксиды СО и СО2, угольная кислота и ее соли – также содержат углерод. Поэтому дают следующее определение органической химии:
Органическая химия – это химия углеводородов и их производных.
Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят из атомов, только двух элементов: С и Н. Например: СН4, С2Н6 и т.д.
Производные УВ – это продукты замещения атомов «Н» в молекулах УВ на другие атомы или группы атомов. Например:
СН4 → СН3Сl
С2Н6 → С2Н5F
Принципиального отличия между органическими и неорганическими веществами нет.
В настоящее время известно более 15 млн. органических соединений.
3. Дальнейшее развитие органической химии
Дальнейшее развитие науки требовало создания новой, более прогрессивной теории. В создание такой теории органической химии внесли свой вклад ученые нескольких стран — в первую очередь русский ученый А. М. Бутлеров, шотландец Купер и крупнейший немецкий химик Кекуле.
Кекуле (одновременно с его соотечественником Кольбе) установил четырех валентность углерода и (одновременно с Купером) развил идею о способности углеродных атомов соединяться в длинные цепи. в химических соединениях с помощью черточек. Начиная с 1858 г. А. М. Бутлеров развивает и экспериментально обосновывает теорию химического строения. А. М. Бутлеров исходил из материалистических представлений, основанных на атомистическом учении М. В. Ломоносова и Дальтона. Сущность этой теории сводится к следующим основным положениям.
1. Химическая природа каждой сложной молекулы определяется природой составляющих ее атомов, их количеством и химическим строением.
2. Химическое строение — это определенный порядок в чередовании в молекуле атомов, во взаимодействии, взаимном влиянии атомов друг на друга (как соседних, так и через другие атомы).
3. Химическое строение веществ определяет их физические и химические свойства.
4. Изучение свойств веществ позволяет определить их химическое строение.
В отличие от ранее существовавших теорий теория химического строения позволяла классифицировать весь накопившийся и новый экспериментальный материал и, что самое важное, предсказывать возможное число органических соединений определенного состава и вероятные пути их синтеза, т. е. допускала экспериментальную проверку. Она стала общей теорией органической химии как науки.
В 70-х годах XIX в. теория строения дополнилась теорией пространственного расположения атомов в молекулах — стереохимической теорией (Вант-Гофф, Лебедь). Создание теории химического строения способствовало бурному развитию органической химии и в последней четверти XIX в. она приняла современный облик. Уже в конце XIX в. синтетический метод органической химии стал проникать в химическую промышленность. Возникают производства синтетических красителей, взрывчатых веществ, медикаментов. Сырьевую базу для них дает коксохимическая промышленность: необходимые для этих производств органические вещества получают преимущественно из каменноугольной смолы и продуктов ее переработки. Развитие промышленности в свою очередь стимулировало научные исследования.Классификация неорганических веществ – оксиды, кислоты, соли, основания
В настоящее время известно более 100 тысяч неорганических веществ. Все неорганические вещества можно разделить на классы. Каждый класс объединяет вещества, сходные по составу и по свойствам.
Важнейшими классами сложных неорганических веществ являются: оксиды, основания, кислоты, соли.
Оксиды – это соединения двух элементов, одним из которых является кислород. Общая формула оксидов: Эх ОУ
х – это число атомов элемента, у – число атомов кислорода.
Примеры оксидов: NO, CaO, SO3 и т.д.
Оксиды классифицируются в зависимости от того, каким элементом они образованы:
ОКСИДЫ
Образуются неметаллами и
металлами в высших
степенях окисления
(СO2; Р  O O 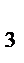 ; Мn2O7 и др.) ; Мn2O7 и др.)
|
Al203, BeO, ZnO, PbO, Cr203, SnO, SnO  , GeO, GeO2, Sb , GeO, GeO2, Sb  O O 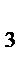 , MnO2 и др. , MnO2 и др.
|
| Образуются металлами (MgO;CrO;CuO и дp) |
Основными оксидами называются такие, которые при взаимодействии с кислотами образуют соль и воду. Соединения этих оксидов с водой относят к классу оснований (например, оксиду Na20 соответствует основание NaOH).
Кислотными оксидами называются такие, которые при взаимодействии с основаниями образуют соль и воду. Соединения этих оксидов с водой относят к классу кислот (например, оксиду Р2O5 соответствует кислота Н3РO4, а оксиду С1207 - кислота НСlO4).
К амфотерным оксидам относятся такие, которые взаимодействуют с кислотами и основаниями с образованием соли и воды. Соединения этих оксидов с водой могут иметь как кислотные, так и основные свойства (например, амфотерному оксиду ZnO соответствует основание Zn(OH)2 и кислота H2ZnO2).
Основания – это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп – «ОН»
Формула оснований: Ме(ОН)х
х – число гидроксильных групп, равное валентности металла.
Примеры оснований: NaOH, Ba(OH)2, Fe(OH)3 и т.д.
Кислоты – это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металла. Общая формула кислот: Нх(Ас)
х – число атомов водорода, равное валентности кислотного остатка,
Ас – кислотный остаток.
Примеры кислот: НСl, H2 SO4, H3 PO4 и т.д.
Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков.
Формула солей: Мех (Ас)у
Примеры солей: NaCl, BaSO4, Mg(NO3)2 и т.д.
|
|
|
|
|
Дата добавления: 2014-11-08; Просмотров: 1659; Нарушение авторских прав?; Мы поможем в написании вашей работы!