
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Массовая доля вещества в растворе, как способ выражения состава раствора
|
|
|
|
Важнейшей характеристикой растворов, влияющей на их свойства, является состав раствора, т.е. содержание растворенного вещества в определенной массе или объеме раствора или растворителя. Существуют различные способы выражения состава растворов. Состав раствора может быть выражен безразмерными (доли, отношения) и размерными величинами (молярная концентрация, массовая концентрация, моляльность, титр и т.д.).
Термин "концентрация" потерял в настоящее время прежнее широкое значение.
Концентрацией называют отношение массы или количества вещества к объему системы (раствора)
Свойства раствора определяются качественным и количественным составом раствора. На практике количественный состав растворов выражают при помощи следующих величин:
а) массовая, объемная и молярная доли, не имеющие единиц величины;
б) молярная концентрация вещества, массовая концентрация вещества, имеющие единицы величины.
1. Массовая доля растворенного вещества w выражается в долях единицы, процентах (%). Массовая доля численно равна от ношению массы растворенного вещества к общей массе раствора:
 . (4.1)
. (4.1)
Масса раствора равна сумме масс растворенного вещества и растворителя:
т(раствора) = т(вещества) + т{растворителя). (4.2)
2. Объемная доля растворенного вещества ф выражается в долях единицы или процентах (%) и численно равна отношению объема жидкого или газообразного вещества к общему объему
раствора или смеси:
 . (4.3)
. (4.3)
3. Молярная концентрация вещества с численно равна отношению химического количества растворенного вещества к объему раствора:
. 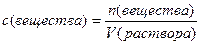 . (4.4)
. (4.4)
Единица СИ - моль/м3, внесистемные единицы величины: моль/дм3, моль/см3, моль/л, моль/мл. Используя формулу
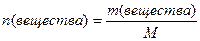 ,
,
преобразуем уравнение (4.4):
. 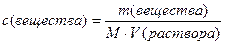 . (4.5)
. (4.5)
Задачи на определение массовой доли вещества в растворе решаются либо через пропорции, либо по уравнениям.
В качестве примеров будут рассмотрены только жидкие растворы, преимущественно, водные.
Растворами называют однородные смеси переменного состава, содержащие два или более вещества.
Из составных частей раствора одно вещество считается растворителем, остальные- растворёнными веществами. Для каждой пары растворённое вещество-растворитель существует граница смешивания, которая характеризует растворимость вещества. Растворы могут быть насыщенными и ненасыщенными. Насыщенным называется такой раствор, в котором растворяемое вещество не переходит в раствор.
Если содержание вещества в растворе меньше растворимости этого вещества, то такой раствор является ненасыщенным.
Количественный состав раствора может быть количественно задан несколькими способами.Мы рассмотрим два способа выражения концентраций: процентная (массовая доля растворённого вещества) и молярная концентрации.
При решении задач часто используется формула, которую вы изучали по физике, формула плотности. Я её здесь приведу.
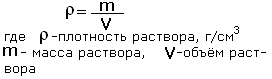
|
|
|
|
|
Дата добавления: 2014-11-08; Просмотров: 4985; Нарушение авторских прав?; Мы поможем в написании вашей работы!