
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вимірювання хімічного складу і концентрації рідини
|
|
|
|
Для вимірюванняхімічногоскладу і концентрації рідини широко застосовують електрохімічні методи, до яких належать кондуктометричні, потенціометричні, кулонометричні та полярографічні методи.
Кондуктометричний метод базується на використанні резистивних електролітичних перетворювачів і широко застосовується для вимірювання концентрації солей, лугів чи кислот у водних чи інших рідких електропровідних розчинах (концентратоміри, солеміри), для вимірювання концентрації газів за зміною електропровідності розчину при поглинанні ним проби аналізованого газу (газоаналізатори), а також для вимірювання вологості в твердих, рідких і газоподібних середовищах (вологоміри).
У лабораторній практиці часто для вимірювання концентрації електролітів використовують зрівноважені мости, в одне з плеч якого вмикають вимірювальну комірку (перетворювач), що являє собою скляну посудину з двома плоско-паралельними елекродами, між якими знаходиться досліджуваний розчин (рис.5.1). Переважно значення опорів резисторів R1 і R2 в цій схемі вибирають однаковими, а схему урівноважують за допомогою магазину опорів Rм. Тоді для зрівноваженого моста вимірюваний опір Rx перетворювача буде дорівнювати Rм.
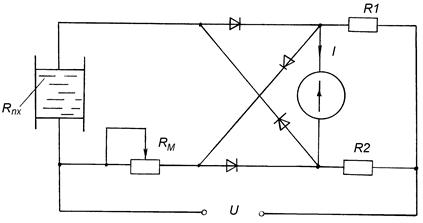
Рисунок 5.1 - Лабораторний кондуктометричний концентратомір
Для знаходження невідомої питомої провідності досліджуваного розчину додатково вимірюють, опір Rо зразкового (градуювального) розчину з відомою провідністю. Стала k перетворювача визначається як
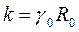 , (5.1)
, (5.1)
а провідність 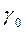 досліджуваної речовини буде дорівнювати
досліджуваної речовини буде дорівнювати
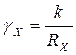 . (5.2)
. (5.2)
Для компенсації фазової похибки, що виникає за рахунок комплексного характеру опору перетворювача на змінному струмі, використовують кільцеву фазочутливу схему випрямлення.
На рис. 5.2 зображена схема промислового кондуктометричного концентратоміра для вимірювань концентрації проточної рідини, який складається з резистивного електрохімічного перетворювача, виконаного у вигляді двох плоско-паралельних пластин, розміщених у досліджуваному розчині. Перетворювач увімкнений в одне з плеч автоматичного моста змінного струму. Резистори R4, R0, R1, R2, що утворюють інші три плеча моста, виготовлені з манганінового дроту. Для зменшення температурної похибки паралельно до плеча R4 вмикають терморезистор RК, занурений в досліджуваний розчин.
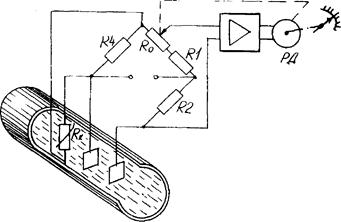
Рисунок 5.2 - Схема промислового кондуктометричного концентратоміра
Протягом аналізу агресивних розчинів використовують безелектродні (безконтактні) кондуктометричні концентратоміри, перевагою яких є відсутність електродів, які могли б поляризуватись чи забруднюватись. Це підвищує надійність і точність безконтактних концентратомірів.
На рис.5.3 показано схему промислового безконтактного кондуктометричного концентратоміра, в якому первинний трансформаторний безелектродний перетворювач складається з силового Т 1 та вимірювального Т 2 трансформаторів, первинні w 1 та вимірювальні w 2 обмотки яких індуктивно зв'язані між собою короткозамкненим витком у вигляді скляної трубки, через яку протікає досліджувана рідина. Трубка з рідиною є одночасно вторинною обмоткою трансформатора Т 1 і первинною трансформатора Т 2. Під дією змінного магнітного потоку, що створюється струмом в обмотці w 1, в рідині індукується ЕРС, внаслідок якої протікає струм Ix. Значення струму пропорційне до γx - питомої електропровідності досліджуваного розчину, а, отже, і невідомої концентрації Сх. Струм Ix створює магнітний потік в осерді трансформатора Т 2 індукуючи в обмотці w2 ЕРС e2, значення якої також пропорційне до вимірюваної концентрації.
ЕРС e2 підсилюється підсилювачем і приводить в рух вал реверсивного двигуна РД, який переміщує повзунок реохорда Rр, змінюючи струм Iк в колі обмотки w 2.В осерді трансформатора Т2 створюється магнітний потік Фк, протилежний до магнітного потоку Ф2, що створюється струмом Ix. У момент рівності цих потоків ЕРС e2 зменшується до порогу чутливості підсилювача і обертання вала РД припиняється, а покажчик шкали займе положення, що відповідає вимірюваній концентрації.
Коло компенсаційного с труму Iк, що живиться від обмотки w1*, як і коло вимірювального струму Ix, мають спільну первинну обмотку w 1, що дає змогу значно зменшити вплив коливань напруги та частоти джерела живлення U.
Для автоматичної корекції впливу зміни температури досліджуваної рідини на покази приладу служить чотириплечний міст, що живиться від обмотки w м і увімкнений вихідною діагоналлю в коло обмоток w 1* та w к і реохорда Rр. Міст утворюють три температурно незалежні (манганінові) резистори R1, R2, R3, та термозалежний опір RТ, розміщений у досліджуваній рідині.
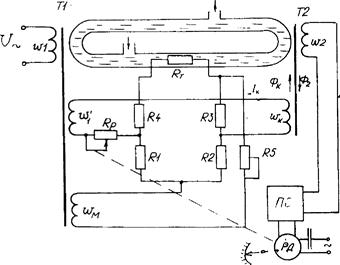
Рисунок 5. 3 - Схема безконтактного промислового кондуктометричного концентратоміра
Кулонометричний метод базується на вимірюванні кількості електрики чи струму протягом електролізу досліджуваної речовини. Фізико-хімічною основою кулонометрії є закон Фарадея
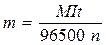 , (5.3)
, (5.3)
де т - маса виділеної речовини в процесі її електролізу, г; М - мольна маса даної речовини; I - сила струму, A; t - час електролізу, с; n - кількість електронів, які беруть участь в окисленні чи відновленні одного моля речовини.
Звідси випливає, що концентрація досліджуваної речовини визначається або за значенням усталеного струму електролізу при заданому сталому потенціалі, або при сталому заданому струмові часом виділення речовини.
Кулонометричний метод використовують для вимірювань концентрації певного компонента (водню, кисню, двоокису вуглецю, вуглеводнів, хлору, фтору тощо) в рідкому і газовому середовищі, а також для вимірювань вологості газів.
Полярографічний метод засновано на знятті полярограми вольт-амперної характеристики електролізу розчину в спеціальному полярографічному перетворювачі. При якісному аналізі, порівнюючи значення напруги Ux (так званий потенціал "півхвилі", що відповідає середині ділянки різкого зростання струму), зі значеннями потенціалів виділення іонів, наведених у спеціальних таблицях, визначають тип іона, що знаходиться в розчині.
При максимальному значенні струму Imax через перетворювач визначають концентрацію іонів у розчині при кількісному аналізі. Полярографічний метод найчутливіший з електрохімічних методів і дає змогу аналізувати багатокомпонентний (5-6 компонентів) склад розчину без їх попереднього розділення. Полярограма має вигляд ступінчастої кривої, кожний ступінь якої характеризує наявність іонів певного типу.
Вимірювальні кола полярографів переважно містять пристрій для автоматичної зміни іонізуючої напруги, компенсувальне коло вимірювання струму, реєструючий пристрій для запису і спостереження полярограм.
Полярографи з ртутно-крапельним перетворювачем (класична полярографія) мають чутливість 10-5...10-6 моль/л, а полярографи, в яких поляризуюча постійна напруга модулюється змінною напругою (осцилографічна полярографія) - 5·10-7...10-9 моль/л.
Велику і різноманітну групу методів об'єднують спектрометричні вимірювання складу і концентрації речовин, що засновані на вибірковій властивості речовин поглинати, випромінювати, розсіювати, заломлювати різного роду випромінювання в широкому спектрі довжин хвиль від звукового діапазону до рентгенівських і гамма-випромінювань. Найцікавішими є радіоспектрометричні методи, основані на використанні таких фізичних ефектів, як ядерний магнітний резонанс, електронний парамагнітний резонанс. Ці методи широко застосовують для досліджень властивостей ядер, молекул різних фізичних речовин, а також, завдяки притаманним цим методам високим метрологічним характеристикам, а також для інших фізико-хімічних досліджень, зокрема для аналізу речовин.
5.3 Вимірювання концентрації водневих іонів, рH-метри
В аналізі розчинів важливими є потенціометричні методи, що базуються на законі Нернста, який встановлює зв'язок між електродним потенціалом та активною концентрацією іонів у розчині. Потенціометричні методи призначено для вибіркового вимірювання активної концентрації певних іонів. Найширше ці методи застосовують для вимірювань активної концентрації іонів водню. Оскільки активну концентрацію іонів водню прийнято виражати водневим показником рН, який чисельно характеризується від’ємним логарифмом активності іонів водню рН =  , то вимірювачі активної концентрації іонів водню одержали назву рН -метрів.
, то вимірювачі активної концентрації іонів водню одержали назву рН -метрів.
Первинні перетворювачі рН -метрів можуть бути побудовані з двох водневих напівелементів, один з яких поміщають в досліджуваний розчин, а інший (електрод порівняння) - в електроліт з нормальною активністю водневих іонів, з'єднуючи обидва напівелементи за допомогою електролітичного ключа. ЕРС такого перетворювача при температурі 18 °С дорівнює
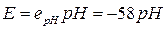 , (5.4)
, (5.4)
де еpH = -58 мВ/рН - питома ЕРС водневого перетворювача.
Використовуючи такий гальванічний перетворювач, можна вимірювати рН в усьому діапазоні значень від 0 до 14. Однак внаслідок незручностей застосування, пов'язаних з необхідністю безперервно подавати до електродів газоподібний водень, водневий електрод може використовуватись хіба що в лабораторних умовах і переважно як зразковий.
Як вимірювальний електрод у гальванічних перетворювачах рН -метрів звичайно використовують скляний електрод, який має властивості водневого електрода. Це пояснюється їх суттєвими конструктивними та експлуатаційними перевагами перед іншими електродами. На скляні електроди не впливає присутність у розчинах окислювальних чи відновлювальних речовин, наявність яких не допускається для інших електродів. Скляні електроди малоінерційні, мають стабільні характеристики.
Як допоміжні використовують хлорсрібні, бромсрібні, рідше каломельні напівелементи. Гальванічний перетворювач, що складається з водневого чи еквівалентного йому скляного напівелемента та допоміжного каломельного, при температурі 18 °С розвиває ЕРС, мВ
 , (5.5)
, (5.5)
а скляний вимірювальний та хлорсрібний допоміжний електрод -
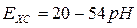 (5.6)
(5.6)
Вибір системи електродів для первинного перетворювача рН- метра, їх конструктивне оформлення та технічні характеристики визначаються умовами експлуатації, діапазоном вимірювання, необхідною точністю. Для промислових pH -метрів електродна система забезпечується додатковою захисною арматурою для захисту від механічних впливів та для кріплення до досліджуваного об'єкта.
Основними складовими похибки первинних перетворювачів pH -метрів є лужна, дифузійна та температурна похибки. Лужна похибка виникає у лужних середовищах у зв'язку з процесами іонного обміну лужних елементів, тобто переходу лужних іонів (натрію чи літію) із мембранного скла скляного електрода в досліджуваний розчин. Лужна похибка знижує значення вимірюваного рН і функціонально залежить як від значення рН, так і від концентрації лужних іонів натрію (чи літію). Одним з основних способів зменшення лужної похибки є розроблення спеціального мембранного скла. Треба також відзначити, що лужна похибка різко зменшується з підвищенням температури.
При вимірюванні рН проточних розчинів у результаті утворення дифузійного потенціалу, що формується на діафрагмі електрода порівняння, виникає так звана дифузійна похибка. Використання в електроді порівняння концентрованих розчинів електролітів з приблизно однаковою рухливістю аніонів і катіонів при дослідженні досить розведених розчинів (з концентрацією менше ніж 0,1 моль/л) дифузійний потенціал не перевищує ±(0,2...0,3) мВ. Для сильноконцентрованих розчинів дифузійний потенціал може досягати до 10 мВ при корисній ЕРС в сотні мілівольт. Для зменшення дифузійних потенціалів допоміжний електрод з'єднують з досліджуваним розчином за допомогою електролітичного ключа, заповненого насиченим розчином КС1, на границях з яким дифузійні потенціали не перевищують 1...2 мВ.
Найбільшою складовою похибки електродної системи рH- метра є температурна похибка, зумовлена залежністю електродних потенціалів вимірювального електрода при незмінному значенні рН від температури. Від температури залежить як складова  , так і складова е0 (і в результаті і Ео), а результуючу ЕРС Еt гальванічного перетворювача при температурі t можна записати у вигляді
, так і складова е0 (і в результаті і Ео), а результуючу ЕРС Еt гальванічного перетворювача при температурі t можна записати у вигляді
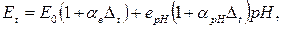 (5.7)
(5.7)
де 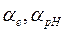 - температурні коефіцієнти відповідних електродних потенціалів,
- температурні коефіцієнти відповідних електродних потенціалів,  – відхилення температури від номінального значення.
– відхилення температури від номінального значення.
При дослідженнях розчинів з високим рН температурна похибка може досягати до 10 %, тому в засобах вимірювань рН необхідно передбачити компенсацію цієї похибки. Але перш ніж перейти до вимірювальних кіл рН -метрів, відзначимо одну особливість температурної залежності ЕРС, а саме, що при певному значенні рНі для заданого перетворювача температурна похибка відсутня, тобто
 (5.8)
(5.8)
звідки 
 .
.
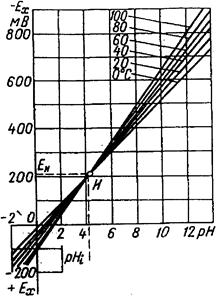
Рисунок 5.4 - Залежність ЕРС гальванічного перетворювача від рН та температури
На рис. 5.4 наведено графіки залежності ЕРС гальванічного перетворювача від рН при різних значеннях температури у вигляді сім'ї прямих (ізотерм), що перетинаються в одній, так званій ізопотенціальній точці А. Координати ізопотенціальної точки (рНi, Еі) залежать від характеру електродів і звичайно визначаються експериментально. Для гальванічного перетворювача Еі =-203 мВ, рНі=4. 13 од.
При створенні рН -метрів необхідно враховувати температурну залежність електродних потенціалів (при незмінному рН) і передбачити температурну компенсацію. Як видно з останнього виразу для 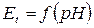 , така компенсація (корекція) можлива за допомогою двох термозалежних опорів.
, така компенсація (корекція) можлива за допомогою двох термозалежних опорів.
Якщо ж врахувати вигляд залежностей 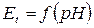 при різних значеннях температури (рис. 5.4) і прийняти за початок координат точку
при різних значеннях температури (рис. 5.4) і прийняти за початок координат точку 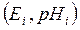 перетину ізотерм, то функція перетворення електродної системи набере вигляду
перетину ізотерм, то функція перетворення електродної системи набере вигляду
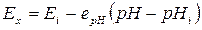 , (5.9)
, (5.9)
а з врахуванням температурної залежності
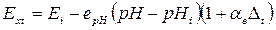 (5.10)
(5.10)
Як випливає з останнього виразу, температурну компенсацію можна в невеликому інтервалі зміни температур здійснити за допомогою одного термозалежного опору.
Принципова схема рН-метра зрівноважувального перетворення з автоматичною корекцією температурної залежності та ручним введенням поправок, що відповідають значенням координат ізопотенціальної точки, наведена на рис. 5.5.
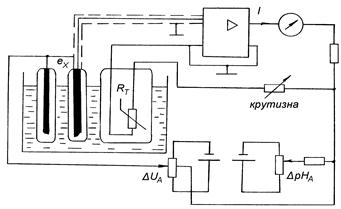
Рисунок 5.5 - Принципова схема рН-метра з корекцією
ЕРС гальванічного перетворення надходить на вхід підсилювача, охопленого глибоким від'ємним зворотним зв'язком, і порівнюється з компенсувальною напругою, значення якої визначається струмом І та параметрами коректувальних елементів кола зворотного зв'язку. При достатньо великому коефіцієнтові підсилення електронного підсилювача значення вихідного струму І буде пропорційним ЕРС Ех , а отже, буде мірою вимірюваного рН.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 2317; Нарушение авторских прав?; Мы поможем в написании вашей работы!