
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамический подход
|
|
|
|
Энтропия
Энтропия (от греч. entropía — поворот, превращение), понятие, впервые введенное в термодинамику Р. Клаузиусом (1865) для определения меры необратимого рассеяния энергии, позволило строго математически сформулировать второй закон термодинамики. Энтропию можно определить с помощью двух эквивалентных подходов – статистического и термодинамического.
Энтропия, функция состояния S термодинамической системы2, изменение которой dS для бесконечно малого обратимого изменения состояния системы равно отношению количества теплоты полученного системой в этом процессе (или отнятого от системы), к абсолютной температуре Т:
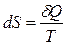 , (1)
, (1)
.где d S – приращение энтропии; δ Q 3 – минимальная теплота, подведенная к системе; T – абсолютная температура процесса.
Величина dS является полным дифференциалом, т.е. ее интегрирование по любому произвольно выбранному пути дает разность между значениями энтропии в начальном (А) и конечном (В) состояниях:
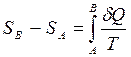 . (2)
. (2)
Теплота не является функцией состояния, поэтому интеграл от δ Q зависит от выбранного пути перехода между состояниями А и В.
Энтропия измеряется в Дж/(моль·К).
Выражения (1) и (2) справедливы только для обратимых процессов.
Для необратимых процессов выполняется неравенство:
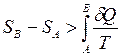 , (3)
, (3)
из которого следует возрастания энтропии в этих процессах.
Свойства энтропии:
1. Энтропия - величина аддитивная, т.е. энтропия системы из нескольких тел является суммой энтропий каждого тела: S = ∑Si .
2. В равновесных процессах без передачи тепла энтропия не меняется. Поэтому равновесные адиабатические процессы (δ Q = 0) называется изоэнтропийным.
3. Энтропия определяется только с точностью до произвольной постоянной.
Действительно, согласно формуле (2) измеренной является лишь разность энтропий в двух состояниях.
Абсолютное значение энтропии можно установить с помощью третьего начала термодинамики (теоремы Нернста): энтропия любого тела стремится к нулю при стремлении к абсолютному нулю его температуры: lim S = 0
при Т → 0К.
Т.о., за начальную точку отсчета энтропии принимают S 0 = 0 при Т → 0 К.
Энтропия – функция, устанавливающая связь между макро- и микро- состояниями; единственная функция в физике, которая показывает направленность процессов. Энтропия – в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике – мера вероятности осуществления какого-либо макроскопического состояния; в теории информации – мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса). Энтропия в информатике – степень неполноты, неопределённости знаний.
Понятие энтропии как показал впервые Э. Шрёдингер (1944), существенно и для понимания явлений жизни. Живой организм с точки зрения протекающих в нём физико-химических процессов можно рассматривать как сложную открытую систему, находящуюся в неравновесном, но стационарном состоянии. Для организмов характерна сбалансированность процессов, ведущих к росту энтропии и процессов обмена, уменьшающих её. Однако жизнь не сводится к простой совокупности физико-химических процессов, ей свойственны сложные процессы саморегулирования. Поэтому с помощью понятия энтропии нельзя охарактеризовать жизнедеятельность организмов в целом.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 842; Нарушение авторских прав?; Мы поможем в написании вашей работы!